

基因在许多骨病病程中发挥着重要的调控作用[1]。近年来,随着基因编辑技术的发展以及新的骨病靶点基因的不断发现,基因编辑动物模型在骨病研究中的应用越来越广泛[2-5]。在骨病研究中,对骨骼组织变化进行多个水平的检测是各个实验的中心环节,在组织学水平,获取体内实验数据的金标准方法是对组织进行包埋切片及染色分析,石蜡包埋法及树脂包埋法是最常用于包埋骨组织的方法[6]。成熟骨组织质地坚硬且脆,使用石蜡包埋前要对骨组织进行脱钙处理[7]。但脱钙后,石蜡切片无法用于骨形成及矿化沉积的分析,而骨形成及矿化沉积是衡量骨重建功能的不可替代的指标[8]。为了能够完整保留骨骼的成分并进行切片分析,有研究提出不需脱钙的树脂包埋法[9]。树脂包埋法中以树脂液代替石蜡,凝固后的树脂标本质地坚韧,不易碎裂,适用于不脱钙骨组织切片及分析[10-14]。树脂包埋切片法现被认为是骨组织学研究的最佳方法之一[6]。传统的树脂包埋切片法仍存在树脂凝固时间长、树脂凝固不完全、在切片采集及染色过程中容易脱片等缺点[15-16]。
针对传统树脂包埋法缺点的改良报道较少,有科研团队尝试构建识别程序以提高效率[17]。有文献报道了一种预防软组织树脂切片发生脱片的方法[16],也有通过改善载玻片的方式进行预防脱片的报道[18]。但国内对不脱钙树脂包埋切片的报道仍以介绍性的报道为主[19-20]。目前国内外尚没有在树脂液凝固、切片、染色过程中对树脂包埋不脱钙骨技术的改良方法的报道。为提高不脱钙骨组织的树脂包埋法的效率及稳定性,我们对大量实验经验进行了总结,尝试对传统的树脂包埋切片法进行改良。结果发现,将复数胫骨样本平行包埋于一个树脂块中有效可行,提高了树脂块的利用率。利用CO2冲入树脂包埋液,可有效缩短树脂凝固时间并提高树脂凝固率。在切片过程中,使用未凝固树脂制备液涂抹切面可显著减少小块硬质骨组织脱片的发生,且不会影响对骨形成的分析。在染色分析前,发现加热切片样本可以降低脱片率,且不影响成骨细胞的分析。改良树脂包埋多个小鼠不脱钙骨组织的方法为树脂包埋不脱钙骨组织研究提供了有效的、高效的方法思路,可能是一种理想的骨组织学研究方法。具体报道如下。

1.1 实验动物
13周龄雄性C57BL/6J 小鼠15 只(Jackson Laboratory),体质量27.3±0.76 g。动物实验经美国特种外科医院实验动物使用与管理委员会以及美国康奈尔大学医学部IACUC批准。
1.2 主要试剂
钙黄绿素、壬基苯基-聚乙二醇乙酸酯(NPG)、过氧化苯甲酰(BPO)、丁二醇、甲苯胺蓝O、固绿FCF、无水切片封固剂及1-乙酰氧基- 2-甲氧基乙烷(AME)(Sigma)。单体甲基丙烯酸甲酯(MMA)、N,N-二甲基-对甲苯胺(DMPT)(WAKO)。氧化铝60、水性切片封固剂(Millipore),尿素(Fisher Scientific)。
1.3 小鼠骨组织荧光标记及骨组织准备
小鼠在12.3周龄时腹腔注射钙黄绿素(2.5 mg/mL),按每克小鼠体质量注射10 μL,3 d后同剂量注射第2次钙黄绿素,再过2 d后以CO2窒息法处死小鼠[21],取小鼠小腿置于10%福安马林液中固定2 d。随后用镊子及组织剪清除附着于胫骨的肌肉、肌腱等软组织,去除腓骨。将胫骨置于摇床上常温乙醇梯度脱水(70%乙醇1 d→80%乙醇1 d→90%乙醇1 d→100%乙醇2 d),脱水完毕后立即进行树脂液(表1)渗透3 d(第2天更换树脂渗透液1次)。乙醇及渗透液液面应高于包埋盒2 cm。
1.4 树脂包埋液的配制以及凝固时间测试
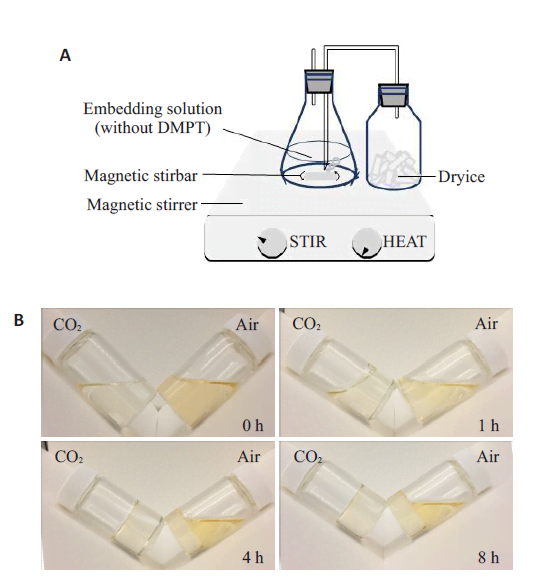
将树脂包埋液按照制备方法的不同分为冲入CO2(实验组)、冲入空气(对照组)两组。实验组:按照NPG7 mL,MMA工作液100 mL,BPO 550 mg比例加入锥形瓶并搅拌,搅拌过程中冲入CO2 15 min(图1A)。然后加入DMPT 500 μL,继续搅拌10 min后进行分装。对照组:按照NPG 7 mL,MMA工作液100 mL,BPO 550 mg比例加入锥形瓶并搅拌,搅拌过程中以电子移液枪辅助冲入空气15 min。然后加入DMPT 500 μL,继续搅拌10 min后进行分装。分别将两组包埋液分装入液体闪烁瓶(20 mL圆柱形玻璃瓶,用于组织包埋,下文中统称为组织包埋瓶)中,10 mL/瓶,每组10瓶,记录并比较两组包埋液的凝固时间及凝固程度。
1.5 复数胫骨的包埋
按照上述冲入CO2组的配制方式制备包埋液。取内径4 mm的火石玻璃管,用乙醇灯烧结封闭玻璃管一端,管内加入包埋液,然后依次将渗透完毕的胫骨置于玻璃管中,两胫骨间隔约4 mm。将玻璃管竖立,开口向上,用包埋液填满玻璃管后以铝箔封口,最上端胫骨距离管口应大于3 cm,4 ℃下凝固4 h。包埋液凝固后,敲碎玻璃管,取出包埋有胫骨的树脂管,用精密金刚石刀轮机(VC50,LECO 公司)在胫骨近端1/4 处切断树脂块。取余长为3/4的胫骨进行第2次包埋。预先用刀轮机制备2 mm×10 mm×10 mm的硬质树脂片作为底板,为复数胫骨切面提供光滑贴合平面。胫骨切面蘸取包埋液,然后竖立贴合在底板上,每块底板放置5根胫骨,共制作6个树脂块用于后续实验。随后将贴合有胫骨的底板平放于组织包埋瓶中,每瓶加入10 mL包埋液,4 ℃下凝固4 h。
1.6 切片及比较切片前涂抹包埋液对脱片的影响
敲碎组织包埋瓶,将树脂块修成合适形状后,选用Leica TC65 硬质标本专用刀片,在全自动旋转切片机(RM2255,Leica)上进行切片。调节树脂块位置与角度,使得刀片切面与复数胫骨切面相平行,切片速度设置为1.5,切片厚度为4 μm。切片时按照是否涂抹包埋液分成涂抹包埋液组与不涂抹包埋液组。涂抹包埋液组:每次切片前在组织块切面滴1滴包埋液,用纱布在切面抹匀,大约10 s 包埋液即会干燥,随后进行切片。不涂抹包埋液组:不涂抹包埋液直接进行切片。两组分别于同一树脂块收集8张切片,使用6个树脂块进行重复实验,记录并比较两组胫骨的脱片情况。对于缺损的胫骨切片,剩余面积大于1/2记为有效的切片,小于1/2记为无效的切片。切片后用展片液(表1)辅助展片,以薄塑料片盖片后用钻床虎钳对切片进行加压,烘箱中55 ℃干燥2 d。
1.7 钙黄绿素荧光分析与比较切片烘干后,置于荧光显微镜下观察钙黄绿素荧光显像情况。利用Osteomeasure 软件分析新骨形成情况。比较涂抹包埋液对骨形成分析的影响。
1.8 探索加热对切片脱塑水化时脱片的影响及成骨细胞染色观察分析树脂切片染色前需要进行脱塑及水化处理。选用来自上述涂抹包埋液组的切片,在脱塑前,按照是否加热随机分成两组,每组24 张切片,其中加热组为实验组,不加热组为对照组。加热组:将切片置于干浴孵化器上95 ℃加热15 min,随后进行脱塑(AME 15 min→AME 15 min)及水化(100%乙醇5 min→100%乙醇5 min→90%乙醇5 min→80%乙醇5 min→70%乙醇5 min→超纯水5 min→超纯水5 min)。不加热组:室温放置切片15 min。随后进行脱塑及水化。水化完成后,统计分析两组脱片情况。随后对切片进行甲苯胺蓝染色。观察并分析成骨细胞数量及成骨细胞表面参数,比较加热对染色情况的影响。
1.9 分析软件及统计方法本实验中骨生成定量分析及成骨细胞定量分析使用Osteomeasure7.1 软件。切片观察使用荧光显微镜(BX53F,Olympus),拍摄使用DP73 显微数码相机(Olympus)及CellSens1.9软件。本实验数据统计分析使用IBMSPSS20.0软件,结果中数据用均数±标准差表示,数据统计使用Student-t分析检验方法进行比较,P<0.05认为差异有统计学意义。
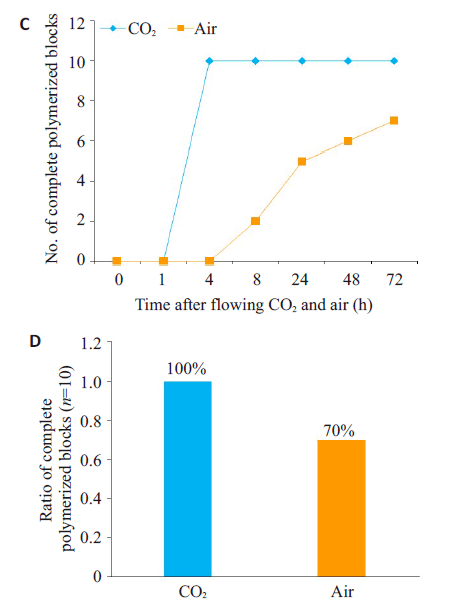
2.1 向包埋液冲入CO2可以缩短包埋液的凝固时间本实验室用CO2冲入包埋液中(图1A),以去除氧气的影响。通过比较冲入CO2及冲入空气两组包埋液,结果发现,在0 h,CO2组的包埋液呈现浅黄色,空气组的包埋液呈现较深的黄色。在1 h时,CO2组的包埋液呈粘稠液体状,空气组的包埋液呈稀释液体状。在4 h, CO2组的包埋液已完全凝固成树脂块,质地坚硬,色泽透明淡黄;空气组部分瓶中的包埋液呈粘稠液体状,部分瓶中包埋液呈稀释液体状,稀释液体颜色深于已凝固树脂(图1B)。在72 h,空气组的包埋液完全凝固瓶数为7瓶,其余3瓶均只有底层包埋液凝固,上层包埋液呈现粘稠液体状。结果显示向包埋液中冲入CO2可以缩短树脂凝固时间(图1C),同时可以提高树脂的凝固成功率(图1D)。
图1 向包埋液冲入二氧化碳可以缩短包埋液的凝固时间Fig.1 Flowing CO2 into the embedding solution reduces polymerization time. A: Schematic diagram of flowing CO2 into theembedding solution; B: Represent pictures showing polymerization of the blocks in CO2 and air groups at 0, 1, 4, and 8 h. The pictures were taken immediately after tilting the vial to observe the viscosity and polymerization of the solution; C: Number of complete polymerized blocks of CO2 and Air groups over time(n=10); D: Rate of complete polymerized blocks of CO2 and Air groups (n=10).
2.2 使用两次包埋的方式可以将多个胫骨包埋于一个树脂块中第1次包埋时将胫骨包埋成圆柱树脂块(图2A),随后将所有胫骨在相同的相对位置切断(距胫骨平台1/ 4处切断胫骨,图2B)。二次包埋时,沾有包埋液的胫骨切面可以与底板贴合紧密,不易倾倒(图2C、D)。
图2 使用两次包埋的方式可将多个胫骨包埋于同一树脂块中Fig.2 Multiple tibias embedded in the same block by 2-step embedding. A: Embedding multiple tibias in a flint glass tube; B: Trimmingthe tibia at the 1/4 proximal part; C: Embedding multiple tibias while maintaining the section plane flat; D: Polymerized block withmultiple tibias.
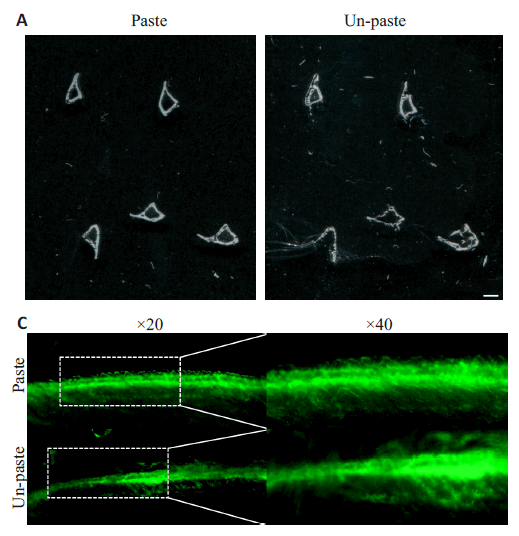
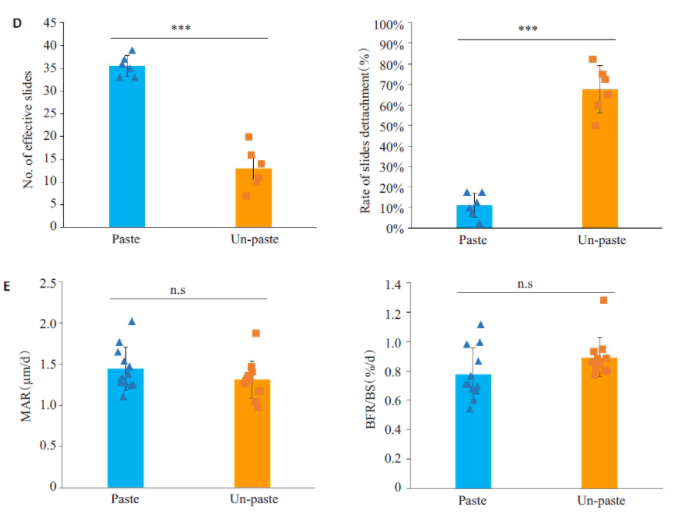
2.3 使用包埋液涂抹切面可以降低切片时脱片率而不影响钙黄绿素荧光分析本实验发现,树脂包埋骨组织切片时,若骨组织切面较小,则容易发生脱片(如颅骨的矢状面切片,长骨的横截面切片),若骨组织相对较大或周围软组织较多,则较少发生脱片(如腰椎的冠状面切片,股骨的冠状面切片)。小鼠胫骨的横截面小,其近中段位置主要为骨髓以及密质骨。密质骨本身质脆坚硬,当对胫骨横截面进行切片时,胫骨周围的树脂难以固定切面胫骨而被一同切下,在切片过程中会出现严重的脱片现象(图3A)。通过计数发现,切片时涂抹包埋液组有效切片数为35.5±2.35,脱片率为(11.25±0.0)%;不涂抹包埋液组的有效切片数为13±4.65,脱片率为(67.5±0.12),涂抹包埋液可以显著减少切片时的脱片的发生(图3D)。涂抹包埋液后,切片更加完整(图3B),不会影响对钙黄绿素荧光的观察(图 3C),涂抹组及不涂抹组的 MAR 及BFR/BS 分析差异无统计学意义(P>0.05)。涂抹包埋液在切面上,因包埋液干燥后可以形成一层树脂膜,这相当于在切面上将所有组织覆盖。当刀片经过切面时,覆盖于其上的树脂膜对切面胫骨起到固定作用,使胫骨与周围树脂一同被切下。

图3 使用包埋液涂抹切面可预防切片时胫骨脱片Fig.3 Application of embedding solution on the section surface prevents slide detachment without affecting calcein labeling analysis.
A: Representative scan pictures of Paste and Un-paste slides(scale bar=1 mm); B: Representative unstained paste and non-paste slides under microscope (left panel: scale bar=200 μm; right panel: scale bar=100 μm); C: Representative fluorescent pictures of paste and non-paste slides (left panel: scale bar=100 μm; right panel: scale bar=50 μm); D: Number of effective slides and rate of slides detachment in paste and non-paste groups (***P<0.001, n=6); E: Mineral apposition rate (MAR, μm/d) and bone formation rate (BFR/BS, %/d) in paste and non-paste groups (n.s: P>0.05, n=12).
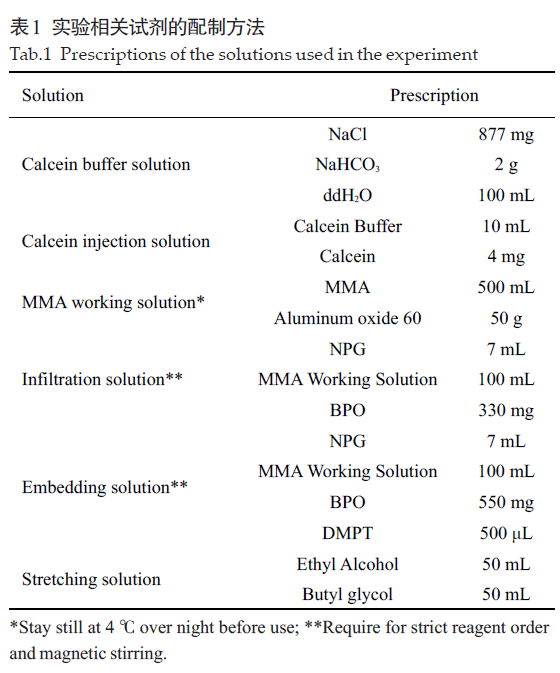
2.4 脱塑前加热切片可以降低水化后脱片率并且不影响甲苯胺蓝染色结果将实验条件设置为95 ℃加热15 min,通过计数发现,加热组在脱塑水化后每张切片剩余有效胫骨切面数3.17±1.31,脱片率为(28.97±0.29)%。不加热组在脱塑水化后每张切片剩余有效胫骨切面数1.92±0.97,脱片率为(56.60±0.22)%。脱塑前加热切片可显著性减少脱塑及水化操作造成的脱片(P<0.001,图4B)。随后对切片进行了甲苯胺蓝染色观察成骨细胞的情况,结果显示,加热并不会影响对甲苯胺蓝染色的染色。加热组和不加热组的成骨细胞分析N.Ob/B.Pm和Ob.S/B.S结果差异无统计学意义(P>0.05,图4C)。
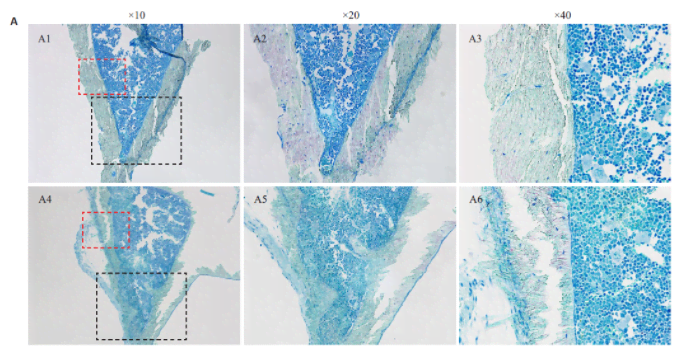
图4 脱塑前加热切片可降低水化后脱片率而不影响甲苯胺蓝染色结果Fig.4 Heating before deplastic and hydration prevents slide detachment during staining without affecting Toluidine blue staining.A: Represent Toluidine blue stain of Heated and Un-heated group (A1,A4 scale bar=200 μm,A2,A5 scale bar=100 μm,A3,A6 scale bar=50 μm); B: Number of attached bones per slide of Heated and Un-heated group after hydration(**P<0.01, n=24); C: Number of osteoblast per bone surface and osteoblast surface per bone surface of Heated and Un-heated group (P>0.05, n=12).
钙黄绿素可以标记骨表面,如果在相同时间间隔进行两次钙黄绿素注射,则可以通过分析两次标记的范围及距离,比较这段时间间隔内新生骨形成的情况,是成骨细胞功能研究中的常用方法[24-25]。由于脱钙后将无法观测到钙黄绿素的标记,因此石蜡包埋法并不适用于观察新生骨形成的变化。不需要脱钙的树脂包埋切片法则能够发挥重要作用,并逐渐在国内得到推广。此外,国内外也有关于不脱钙骨组织的冰冻切片法的报道[23, 26-27],但因需要频繁更换刀片,包埋试剂及切片贴纸价格昂贵,标本需要低温保存等缺点而暂时未能广泛推广。树脂包埋切片耗费的时间较长,如果可以在构建标本块时将多个骨样本按照相同位置包埋固定,切片时的效率就能明显提高。本实验室首次探索了复数胫骨平行包埋的方案,包埋时可以确保所有胫骨切面在同一平面上,切片时位置角度调整方便高效。与传统的包埋方式相比,此方案不仅明显缩短了实验的耗时,还减少了包埋液的使用量,更加节约开支。
传统的树脂包埋方式另一缺点是树脂块需要3~6 d时间才能完全凝固[19],偶尔还会出现无法凝固成硬质树脂块的情况,若在这种情况下尝试包埋多个胫骨,难以保证实验的成功率。既往有文献提出,氧气会影响树脂块的凝固[22]。我们首次尝试在制备包埋液的过程中冲入CO2,在不影响各试剂配比的情况下,明显缩短了树脂块的凝固时间,并且提高了树脂块的凝固成功率。关于冲入CO2可以缩短树脂凝固时间的原因则尚未明确,猜测环境中O2可能可以影响树脂分子交联,CO2冲入可以移除包埋液环境中O2,从而对树脂分子的交联产生保护作用,氮气可能也可以发挥相似作用,但实验室中CO2相对容易获得,因而采用CO2进行实验。
按照本研究包埋方式,第1次包埋时将胫骨包埋成圆柱树脂块,随后将所有胫骨在相同的相对位置切断(距胫骨平台1/4处切断胫骨);二次包埋时,沾有包埋液的胫骨切面可以与底板贴合紧密,不易倾倒。这可以确保在切片时,每个胫骨切面的相对位置几乎一致,不会因为解剖位置差异过大而导致误差。此前,本实验室曾尝试直接切断胫骨后多个胫骨平行竖立包埋,但由于横截面小,胫骨难以竖立在底板上,操作耗时长。直接竖立在底板上的胫骨容易倾倒,切片时无法同时切出相对位置一致的切面,对实验分析造成较大影响。改良后,我们发现采用两次包埋的方式可以将多个胫骨包埋于一个树脂块中,为随后的切片提高了效率。13周龄的小鼠胫骨中段横截面直径大约为1.5mm,如此小的密质骨横截面在切片过程中难以随同树脂一并切下,因而会发生严重的切片脱片现象。因此,我们提出了使用包埋液涂抹的方式辅助切片,并发现其可以显著地降低切片过程中的脱片率。这一方法也可用于预防颅骨矢状面树脂切片脱片。因涂抹的包埋液与树脂成分一致,这种方法并不会影响切片在后续操作中的展片、脱塑以及钙黄绿素荧光分析,是一种优良的切片辅助方式。此外,不脱钙骨组织树脂切片在染色时容易发生脱片。有相关文献报道了不同的防脱片液对预防脱片的效果[18],但制作脱片液耗时较长。有研究通过厚度为10~20 μm的软组织树脂切片进行实验,验证了在115~140 ℃加热30 min后可以预防脱片[16]。本实验室首次尝试使用加热的方法预防不脱钙骨薄切片脱片,发现95 ℃加热15 min可以有效降低脱塑水化后的脱片率,并且不会影响甲苯胺蓝染色的观察以及成骨细胞的分析。小鼠是骨科基础研究中的重要模型[5, 28],而尽量保留骨骼成分对骨组织学研究有重要意义。本研究对传统的树脂包埋不脱钙骨组织方法进行了探索与改良,提出同时包埋复数小鼠不脱钙胫骨的方法,提高了获得及分析新生骨形成及骨矿化数据的效率,这一方法可能是一种理想的不脱钙骨组织研究方法。但在树脂包埋不脱钙骨组织实验中,依然存在一部分待解决的问题,比如切片在的展片过程中容易发生变形,切片干燥后难以与覆盖其上的塑料片分离等。本研究将在未来的实验中对这些问题进行进一步的探索,继续优化利用树脂包埋不脱钙骨组织的方案。


[1] Karasik D, Rivadeneira F, Johnson ML. The genetics of bone massand susceptibility to bone diseases[J]. Nat Rev Rheumatol, 2016, 12(6): 323-34.
[2] Brown SD, Holmes CC, Mallon A, et al. High-throughput mouse phenomics for characterizing mammalian gene function[J]. Nat Rev Genet, 2018, 19(6): 357-70.
[3] Morris JA, Kemp JP, Youlten SE, et al. An atlas of genetic influences on osteoporosis in humans and mice[J]. Nat Genet, 2019, 51(2): 258-67.
[4] Tachmazidou I, Hatzikotoulas K, Southam L, et al. Identification of new therapeutic targets for osteoarthritis through genome-wide analyses of UK biobank data[J]. Nat Genet, 2019, 51(2): 230-45.
[5] Elefteriou F, Yang X. Genetic mouse models for bone studies--strengths and limitations[J]. Bone, 2011, 49(6): 1242-54.
[6] Varela A, Jolette J. Bone toolbox: biomarkers, imaging tools, biomechanics, and histomorphometry[J]. Toxicol Pathol, 2018, 46(5): 511-29.
[7] David LT. A method of preparing paraffin sections of bone[J].Science, 1935, 82(2121): 179-91.
[8] Zaidi M. Skeletal remodeling in health and disease[J]. Nat Med,2007, 13(7): 791-801.
[9] Mawhinney WH, Ellis HA. A technique for plastic embedding of mineralised bone[J]. J Clin Pathol, 1983, 36(10): 1197-9.
[10]李梁, 李海燕, 霍东升, 等. 大鼠股骨头骨松质树脂包埋体视显微观察方法介绍[J]. 中国临床解剖学杂志, 2015, 33(1): 115-6.
[11]郭泽鸿, 容明灯, 朱安棣, 等. 含种植体硬组织骨计量学不脱钙塑料包埋技术[J]. 广东医学, 2008, 29(3): 385-6.
[12]吕荣, 徐新智, 王军. 塑料包埋不脱钙大块骨组织切片及染色[J]. 临床与实验病理学杂志, 2002, 28(3): 342-54.
[13]刘绍泉. 塑料包埋不脱钙骨组织玻璃刀切片技术[J]. 中华病理学杂志, 1996, 18(1): 49-61.
[14]王勇平, 李晓琴, 张辉, 等. 塑料包埋结合四环素荧光标记制作不脱钙骨组织切片的实验研究[J]. 临床与实验病理学杂志, 2012, 28(5):543-5.
[15]谭见容, 杨小红, 康宁, 等. 应用甲基丙烯酸甲酯包埋不脱钙骨组织方法的探讨[J]. 中国矫形外科杂志, 2009, 17(7): 534-6.
[16]Xiang Y, Yang Z. Detachment of methacrylate-embedded sections from microscope slides can be prevented by heating on hotplate[J]. J Histol Histopathol, 2014, 1(1): 87-99.
[17]van TR, Rose L, Bassonga E, et al. Open source software for semiautomated histomorphometry of bone resorption and formation parameters[J]. Bone, 2017, 99(1): 69-79.
[18]王东胜, 赵征, 吕燕. 四种防脱片剂在不脱钙骨组织切片中的应用研究[J]. 中华老年口腔医学杂志, 2011, 9(6): 329-31.
[19]梁化印, 郭瑞峰, 杜双存, 等. 塑料切片技术介绍[J]. 临床与实验病理学杂志, 2004, 25(5): 632-4.
[20]李建赤, 黄必留, 徐自强. 骨组织形态计量学在临床骨病应用中的研究与进展[J]. 中国组织工程研究与临床康复, 2011, 15(35): 6607-10.
[21]Inoue K, Deng ZH, Chen YF, et al. Bone protection by inhibition of microRNA-182[J]. Nat Commun, 2018, 9(1): 4108-19.
[22]Erben RG. Embedding of bone samples in methylmethacrylate:an improved method suitable for bone histomorphometry, histochemistry, and immunohistochemistry[J]. J Histochem Cytochem,1997, 45(2): 307-13.
[23]Hill EL, Elde R. An improved method for preparing cryostat sections of undecalcified bone for multiple uses[J]. J Histochem Cytochem,1990, 38(3): 443-8.
[24]Erben RG, Glosmann M. Histomorphometry in rodents[J]. Methods Mol Biol, 2012, 81(6): 279-303.
[25]Bloebaum RD, Willie BM, Mitchell BS, et al. Relationship between bone ingrowth, mineral apposition rate, and osteoblast activity[J]. J Biomed Mater Res A, 2007, 81A(2): 505-14.
[26]Kawamoto T. Use of a new adhesive film for the preparation of multipurpose fresh-frozen sections from hard tissues, whole-animals, insects and plants[J]. Arch Histol Cytol, 2003, 66(2): 123-43.
[27]孙振, 尹合勇, 眭翔, 等. 冰冻切片法观察不脱钙骨组织的荧光分布[J]. 中国修复重建外科杂志, 2015, 29(11): 1429-33.
[28]Peters LL, Robledo RF, Bult CJ, et al. The mouse as a model for human biology: a resource guide for complex trait analysis[J]. Nat Rev Genet, 2007, 8(1): 58-69.












 扫一扫 关注我们
扫一扫 关注我们