

氟是人体必需的微量元素,适量的氟有利于机体钙和磷的利用,增加骨骼的硬度,但长期超生理剂量摄入可导致氟骨症。铝是不是人体必需的元素尚无定论,但它在体内蓄积到一定程度后会产生毒性作用,也会造成软骨和骨的损害。由于环境中氟铝元素多于正常,贵州省部分地区还有氟铝中毒导致骨骼严重畸形的病例,且易发骨质疏松症[1-2]。长期饮用砖茶(氟铝含量高),也是内蒙古及东北地区的人群可能发生氟铝联合中毒的高危因素[3]。因此氟铝联合中毒的深入研究仍然具有重要的现实意义。
目前关于氟铝联合中毒的实验研究,多数集中探讨骨骼损害与氟铝剂量的关系,并且大多是基于体外实验结果[4-5],对于短期氟铝暴露以及停止暴露后药物干预对骨重建状态及长骨生长发育影响的研究还少见报道。因此,本研究通过骨组织形态计量学方法观察氟铝摄入不同时间以及停止氟铝暴露后药物干预对大鼠长骨纵向生长以及骨重建的影响,为地方性氟铝联合中毒的深入研究和防治提供理论依据。
一、材料与方法
1.1 试剂与仪器
氟化钠( NaF; CAS: 7681-49-4; 批号: 20130528; 天津市光复精细化工研究所生产) ,氯化铝( AlCl3; CAS:7446-70-0; 批号: 20121102; 天津市福晨化学试剂厂生产) ,牡蛎碳酸钙片( 25mg·片-1,批号: 120304; 广州白云山光华制药股份有限公司生产) ,罗盖全( 0.25 μg·粒-1,批号: 20130011; 上海罗氏制药有限公司生产) 。染色剂甲苯胺蓝( CAS: 92-31-9; 批号:
71041284; Sigma Chemical Co.美国生产) ; 包埋单体甲基丙烯酸甲酯( CAS: 1330-20-7; 批号: 20161017; 北京化工厂生产) 。不脱钙制片所需慢速锯( Buehler,美国) ,硬组织切片机( Leica RM2265,德国) ; 骨形态计量分析所需荧光显微镜( DMLB,Leica,德国) 及显微照相机( Olympus DP72,日本) ,骨形态计量学测量系统( OsteoMetrics3. 1, Inc,美国) 。
1.2 分组及给药
48只2 月龄清洁级SD大鼠,雌雄各半,随机分成6组: 对照45d和90d组,氟铝45d组和氟铝90d组[氟铝( 30mg·kg-1·d-1 NaF + 0.1 mg·kg-1·d-1AlCl3) 暴露45d组和90d组],氟铝中断组( 氟铝45d后停止暴露) ,药物干预组[氟铝45d 后停止暴露并给予钙加维生素D( 37.5g·kg-1·d-1 钙+ 0.052 μg·kg-1·d-1维生素D) 联合治疗]。年龄对照组用生理盐水按10 ml·kg-1用量灌胃,所有药物配置成一定浓度的溶液,每日1次灌胃,分别给药45d和90d。动物分笼饲养,保持条件: 室温24~28 ℃,湿度50%~60%。实验期间根据每周称重调整灌胃给药量。
1.3 骨形态学标本制备及形态计量学参数测量
左侧胫骨除净肌肉和软组织,矢状面锯掉胫骨粗隆部分,暴露骨髓腔,横断后取约1cm的胫骨近端固定液中存放,之后经逐级脱水、脱脂,甲基丙烯酸甲酯包埋,打磨光滑后再经硬组织切片机切成10μm和5μm的切片。厚片荧光显微镜下进行骨代谢及小梁微结构的测量分析。薄片甲苯胺蓝法染色,光镜下观察骺板( 生长板) 软骨细胞层,初级骨小梁以及初级小梁往下延伸3 mm 区域内的次级小梁并进行相关计量学分析。其测量范围及参数含义参见相关文献[6]。
主要微结构参数有骨小梁容积/总容积( bone volume /tissue volume,BV/TV) 、骨小梁厚度( trabecular thickness,Tb.Th) 、骨小梁数量( trabecular number,Tb.N) 、骨小梁分离度( trabecular separation,Tb.Sp) 及生长板厚度( growth plate width,G. P. Wi) 等,骨小梁容积即骨量。反映骨形成的参数有骨小梁荧光周长/骨小梁周长( mineralization surface /bone surface,MS /BS) 、骨形成率( bone formation rate /tissue volume,BFR/TV) 、成骨细胞周长( osteoblast surface,Ob.S) 、类骨质周长( osteoid surface,O.S) 及骨吸收参数破骨细胞周长( osteoclast surface,Oc.S) 等。骨建造单位( bone modeling unit,BMU) 和骨重建单位( bone remodeling unit,BRU) 分别计数。骨建造单位的判断标准是: 附着于小梁表面,胶原纤维走向与旧骨一致,黏合线( 与旧骨的分界) 光滑,小梁表面双荧光标记多见( 无荧光的小梁不计算在内) ,小梁的大小、形状往往发生改变。骨重建的特点是: 发生在吸收陷窝内,新骨形状像一个袋子,纤维走向与旧骨不同,黏合线粗糙,不够光滑,可见双荧光或单荧光,小梁基本维持原状。可疑者及骨形成静止表面( 无荧光) 均不计算在内。
1.4 统计学处理
采用SPSS 18. 0 软件进行统计学分析。计量资料以x ± s 表示,不同实验周期( 45d 和90d) 氟铝暴露的影响采用双因素方差分析,相同实验周期( 90d) 各处理因素的影响采用单因素方差分析,再分别采用LSD-t 检验进行组间两两比较。P < 0.05 为差异具有统计学意义。
2 结果
2.1 停止氟铝暴露及药物干预对大鼠体重的影响
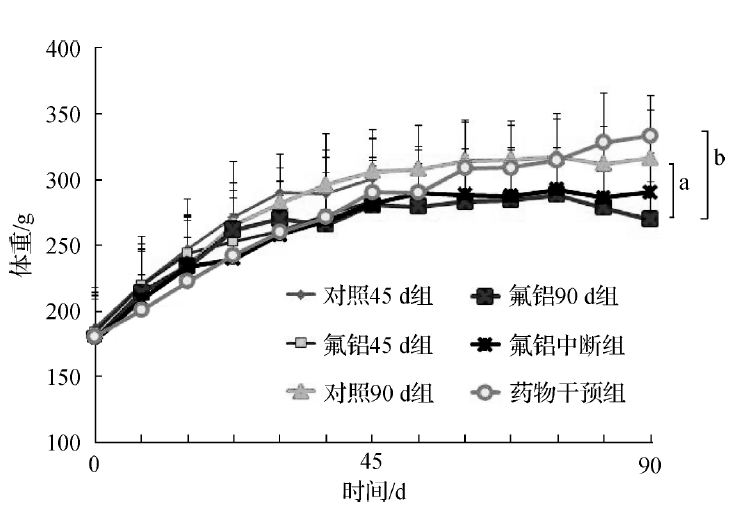
短期( 45d) 内不管是否摄入氟铝,大鼠体重都是逐渐增加的。随后,氟铝组体重不增甚至下降,实验结束时,氟铝90d的体重比对照90d组下降了14.90%( P < 0.05) 。药物干预组体重则比氟铝90d组增加18.90% ( P < 0.05) 。氟铝中断组体重介于药物干预组和对照90d组之间。
a 氟铝90d组与对照90d组比较,P < 0.05; b 药物干预组与氟铝90d组比较,P < 0.05
图1 停止氟铝暴露及药物干预后大鼠体重的变化
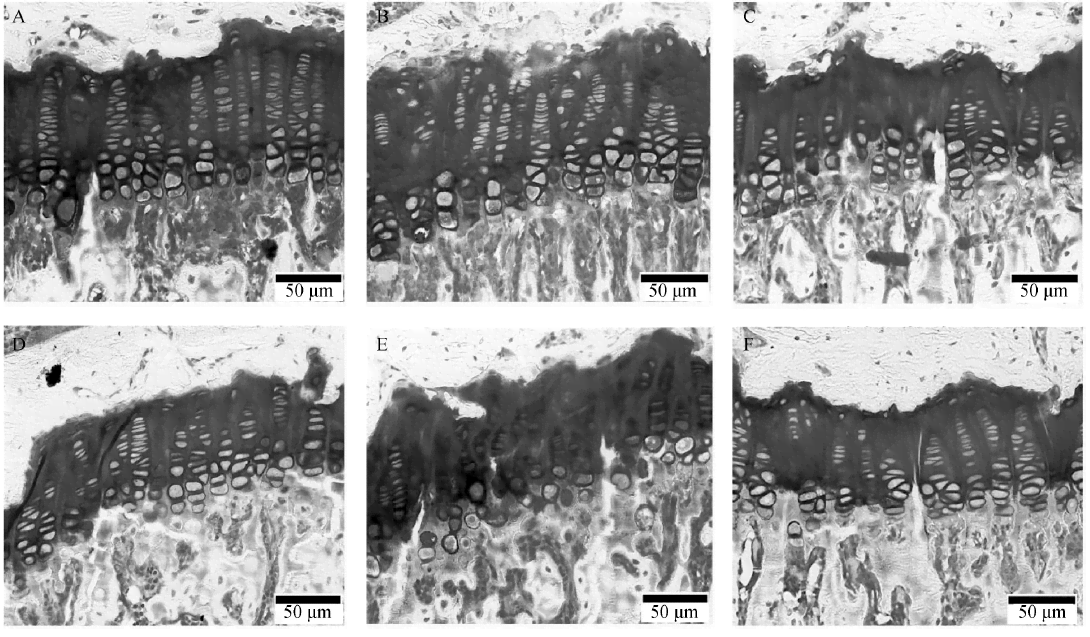
2.2 停止氟铝暴露及药物干预后大鼠胫骨G. P. Wi及细胞形态的变化
与相应年龄对照组比较,氟铝45 d组和90 d 组的G.P.Wi 分别增加了27.8%( P<0.01) 和34. 53%( P<0.01) 。氟铝45 d 组软骨细胞层次清楚,排列整齐,形态无异常,而氟铝90 d 组肥大细胞拥挤,潴留。氟铝中断组的G. P. Wi 为( 173. 43 ± 12.21) μm,高于对照90 d 组的( 136.62 ± 6.54) μm( P < 0.05) 。药物干预组的G.P.Wi( 150.35 ± 10.25) μm,低于氟铝90 d 组的( 183.80 ± 17.59) μm( P < 0.05) ,与对照90 d 组接近,且软骨细胞层次清楚,形态未发现异常。
A.对照45d组; .氟铝45d组; C.氟铝中断组; D.对照90d 组; E.氟铝90d 组; F.药物干预组
图2 停止氟铝暴露及药物干预后大鼠胫骨G.P.Wi 及细胞形态的变化(甲苯胺蓝染色× 400)
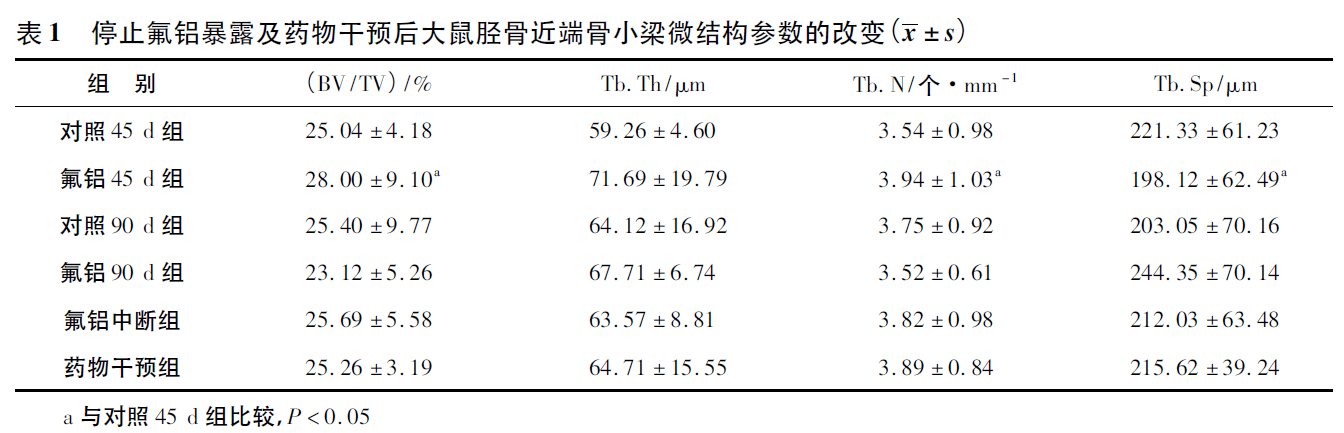
2.3 停止氟铝暴露及药物干预后大鼠胫骨近端骨小梁微结构的改变
氟铝45d组与对照45d组比较,BV/TV、Tb.N 增加,Tb.Sp 降低。其余各组比较差异均无统计学意义,见表1。
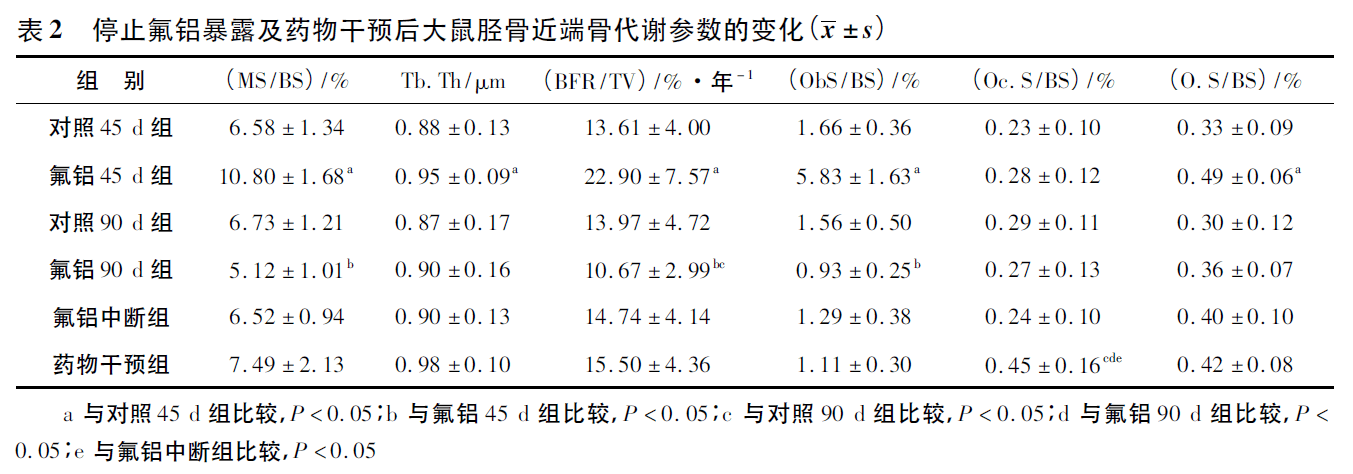
2.4 停止氟铝暴露及药物干预后大鼠胫骨近端骨小梁骨重建的改变
与对照45d组比较,氟铝45d组的MS /BS、BFR/TV、Ob.S 及O.S 明显增加。氟铝90d组的上述指标比氟铝45d组明显下降,BFR/TV 和Ob.S 甚至要低于对照90d 组。氟铝中断组的各项指标与年龄对照90d组和氟铝90d组相比差异均无统计学意义。药物干预组的Oc.S 明显比对照90d 组,氟铝90d组和氟铝中断组增加。见表2。
氟铝45d组的骨形成增加主要是以骨建造为主,即新骨形成增加( 箭头所示) ,见图3A。氟铝45d组的BMU/BRU 高于对照45d组( 3.11 ± 0.28 vs 1.44 ±0.42,P < 0.05) ; 氟铝90 d 组的BMU/BRU 低于氟铝45d组( 0.67 ± 0.28 vs 3.11 ± 0.28,P < 0.01) ,与对照90d组差异无统计学意义。氟铝中断组BMU/BRU 仍高于氟铝90d组( 1.50 ± 0.42 vs 0.67 ± 0.28,P <0. 05) 。药物干预组表现为骨重建比例增加,即旧骨改造增加( 箭头所示) ,见图3B。药物干预组的BMU/BRU 明显低于氟铝中断组( 0.25 ± 0.08 vs 1. 50 ±0. 42,P < 0.05) ,甚至低于对照90 d 组( 0.25 ± 0.08vs 0.72 ± 0.19,P < 0.05) 。

A. 氟铝45d组; B.药物干预组
图3 氟铝45d组和药物干预组大鼠胫骨近端骨小梁骨重建状态( 甲苯胺蓝染色× 400)
3 讨论
长骨生长板( 即骺板) 中的软骨细胞持续的增殖分化过程决定着长骨的生长。体外研究[7]结果表明,氟对软骨细胞呈现低剂量促进、高剂量相对抑制其功能的双向作用。动物体内实验( 短的60d,长至6个月) [8-9]发现,氟或氟铝造成大鼠骺板增厚,软骨矿化延迟甚至坏死。本实验发现,氟铝在体内短期促进、长期抑制软骨细胞功能。这是因为氟和铝都是带电荷的离子,可引起体内细胞内外Ca2 + 浓度的改变,影响钙的正常代谢,软骨基质不能及时矿化为初级小梁骨。同时,氟铝对软骨细胞均有直接毒性作用,氟直接损伤细胞线粒体和内质网,铝竞争性抑制蛋白聚糖与基质胶原结合,形成不成熟的软骨基质[10-11],还在体内与Ca2+、Mg2+、Fe2+等阳离子竞争,干扰细胞能量代谢。短期氟铝暴露时,体内内环境存在一定的代偿,仅表现出对软骨细胞的刺激作用。然而,随着暴露时间的延长,氟铝对软骨细胞和基质的毒性作用逐渐累积并显现。氟铝组的体重变化( 先增后减) 也间接支持了长期氟铝暴露对长骨生长的抑制作用。钙和维生素D对生长板细胞并没有显著影响,但体重的恢复间接说明了药物干预对整体的积极效应。本实验的结果还发现,氟铝联合短期暴露刺激骨形成,长期则抑制骨形成,骨吸收的改变则不明显。目前已经明确成骨细胞功能活跃是氟骨症骨病变中一个发生较早、并起主导作用的环节[12]。成骨细胞的激活与细胞内Runt 相关转录因子2( Runx2) 、Wnt /β-连环蛋白、骨形态发生蛋白( BMP) 、磷脂酰肌醇3-激酶( PI3K) /Akt、刺猬蛋白( Hedgehog) 、胰岛素受体等一系列的信号调控通道均有关[13-14],继而改变相关基因或蛋白的表达,对成骨细胞的增殖分化,凋亡,甚至对细胞外基质的分泌、矿化等产生影响。此外,氧化应激和内质网应激,细胞内外钙矛盾机制也与氟对成骨细胞的激活密切相关[15]。铝对成骨细胞的功能则是抑制的,主要还是对细胞的直接毒性作用[16]。本实验中,氟铝短期内只激活骨形成,不但印证了成骨细胞激活是最先启动的环节,同时也说明,在高氟低铝的联合摄入中,短期内仍是以氟的作用为主,或者氟对骨形成的刺激作用掩盖了低铝直接抑制骨形成的作用。相对而言,氟铝对破骨细胞的作用存在许多争议。有实验[17]证明,氟对体外培养的小鼠破骨细胞也有低剂量促进,高剂量抑制的双向作用。体内实验[18]则发现,氟暴露时破骨功能活跃,骨吸收、骨转换均增加,但多数是基于血清和生化检测结果,基本没有直观的形态学资料和数据。本实验结果发现,不管氟铝暴露时间长短,Oc.S 并没有明显改变。BMU/BRU 增加说明氟铝短期暴露时,促进新骨形成。这种骨建造的特点就是在不同的骨小梁表面发生,不与骨吸收偶联,也解释了骨吸收为什么没有随着骨形成的增加而增加。
药物干预组的骨吸收明显增加,BRU 也增加,说明钙和维生素D 干预促进旧骨改造。由于氟离子置换羟基磷灰石中的羟基,形成难溶的氟磷灰石在骨中沉积。铝是三价的金属离子,在体内与磷酸盐形成难溶性磷酸铝盐,也在骨骼沉积。因此,虽然氟铝短期暴露时成骨是增加的,但并非完全是正常沉积的羟基磷灰石成分。另外,氟和铝可通过多种途径导致整体低
钙-靶细胞内高钙的钙矛盾现象[19]。在这种情况下给予钙和活性维生素D,细胞内外Ca2 + 浓度差将产生变化,诱发单核巨噬细胞和破骨细胞内的钙振荡,使破骨细胞数量增多、功能活跃,增加对陈旧骨基质的吸收[20],因此,药物干预组的骨重建增加,是以正常的钙磷灰石替代了氟磷灰石、磷酸铝盐等异常的沉积物,对骨小梁的质量将发挥积极的影响。
综上所述,氟铝暴露短期内促进长骨生长和骨建造为主的骨形成,长期则抑制骨生长及骨形成。氟铝停止暴露后短期促进作用逐渐消失。停止氟铝暴露后给予钙和维生素D 联合干预治疗不增加骨形成,但增加骨吸收,促进旧骨改造,改善骨质量。
[参考文献]
[1]李福成,颜书林,丛旭滋,等. 地方性氟中毒病区高铝氟负荷骨变形儿童血清Ca2 +、P5 +、Mg2 +、Fe2 +、Zn2 + 含量检测分析[J]. 当代医学, 2014, 25( 7) : 155-156.
[2]罗琳,姚鑫,黄娴,等. 贵州少数民族女性特发性骨质疏松的临床特点及其相关因素调查[J].东南大学学报( 医学版) , 2016, 35( 2) : 180-183.
[3]刘庆斌,李海蓉,刘学慧,等. 西藏昌都县藏族居民氟铝总摄入量调查[J].中国地方病防治杂志,2014,25 ( 2 ) :85-87.
[4]白静,陈瑶. 氟铝联合中毒研究进展[J]. 医学综述,2009,15( 7) : 1074-1075.
[5]李心慰,张立超,胡崇伟,等. 慢性铝暴露致大鼠骨与软骨损伤胶原途径的动态分析[J]. 环境科学学报,2010,30( 4) : 841-846.
[6]DEMPSTER D W,COMPSTON J E,DREZNER M K,et al.Standardized nomenclature, symbols,and units for bone histomorphometry:a 2012 update of the report of the ASBMR Histomorphometry Nomenclature Committee[J].J Bone Miner Res, 2013, 28( 1) : 2-17.
[7]朱志坚,于燕妮,陶欣,等. Hh 信号通路在氟致大鼠原代软骨细胞损伤中作用[J].中国公共卫生,2015,31 ( 5 ) :574-578.
[8]申筑. 氟/铝暴露对大鼠脊柱及脊柱组织Runx2、Osterix 的影响[D].贵阳: 贵州医科大学. 2016.
[9]申筑,林少凯,喻茂娟,等. 燃煤型氟中毒对大鼠骺板软骨组织形态学的影响[J].现代预防医学,2016,43 ( 16 ) :2917-2920.
[10]张洁靖. Hh 信号通路对氟中毒大鼠软骨损害的影响[J].中国地方病防治杂志, 2016, 31( 1) : 25-27.
[11]朱志坚,陶欣,于燕妮. 刺猬信号通路在氟中毒软骨损害机制中的研究进展[J].医学综述, 2015, 21( 18) : 3294-3296.
[12]赵军,张文岚,张伟,等. 氟中毒大鼠成骨细胞激活与bFGF、c-fos /c-jun 表达研究[J].中国实验诊断学,2010,14( 8) : 1183-1186.
[13]王勇平,欧阳元明,蒋垚. 成骨细胞分化及增殖调控的研究进展[J].上海交通大学学报( 医学版) ,2011,31 ( 10) :1465-1469.
[14]于燕妮,邓超男. 刺猬蛋白信号通路在氟对骨骼损伤中的作用[J]. 中华病理学杂志,2014,43( 1) : 68-70.
[15]张亚楼,孙小娜,李甜,等. 染氟成骨细胞内质网应激分子及骨转化功能的变化[J].卫生研究,2014,43 ( 6 ) :967-971.
[16]孙旭东,李艳飞. 三氯化铝抑制大鼠骨形成及Wnt /β-catenin信号转导机制[D]. 哈尔滨: 东北农业大学. 2016.
[17]白生宾. 氟对破骨细胞增殖的影响及可能的分子机制[D].长沙: 中南大学. 2012.
[18]杨德山,洪峰. 氟、砷染毒对大鼠破骨细胞骨吸收能力的影响及其机制[J].环境与职业医学, 2018, 35( 4) : 297-302.
[19]REN R,ZHANG Y,ZHANG X F, et al. Aluminum neurotoxicity effects on intracellular Ca2 + homeostasis in the rat cerebraIcortex[J]. Neural Regen Res, 2010, 5( 15) : 1180-1184.
[20]BOUDOT C,SAIDAK Z,BOULANOUAR A K, et al. Implication of the calcium sensing receptor and the Phosphoinositide 3-kinase /Akt pathway in the extracellular calcium-mediated migration of RAW 264. 7osteoclast precursor cells[J].Bone,2010, 46( 5) : 1416-1423.





 扫一扫 关注我们
扫一扫 关注我们