

作为一种全身代谢性疾病,2型糖尿病(type 2diabetes mellitus,T2DM)对患者的口腔健康,尤其是牙周组织健康有重要影响, 研究表明T2DM患者群体的缺牙率显著高于全身健康人群[1-2]。口腔种植修复治疗以其生理功能更接近天然牙、不损伤邻牙等的优点备受患者青睐。
T2DM 患者拔牙窝愈合速度慢,若采用传统口腔种植治疗,不仅延长了等待拔牙窝完全愈合的时间,而且需要行骨增量[3-4];此外,传统口腔种植治疗的二期手术也增加了T2DM患者炎症及感染的风险[5]。若将即刻种植即刻修复(immediate implant placement and immediate restoration,IIPIR)用于T2DM患者,则可以缩短治疗周期,避免二期手术,简化修复步骤,因而进一步改善T2DM患者口腔种植修复治疗体验,缩短整体治疗周期。即刻种植即刻修复是拔除患牙后、即刻进行口腔种植体植入,并即刻安装临时修复体的治疗方案,这一技术充分利用了拔牙位点余留的牙槽骨,可实现骨改建和骨结合的同期进行,缩短治疗周期,减少外科手术步骤,获得更好的美学效果[6-8]。随着口腔种植技术的不断发展,现有的基础及临床研究表明,T2DM患者在控制血糖水平稳定、加强感染防控的前提下,可获得与全身状况健康人群相近的预后[9-11]。而T2DM个体能否与全身健康的缺牙患者一样采用即刻种植即刻修复,目前仍缺乏相关的临床研究及动物实验提供参考。现有的关于即刻种植即刻修复的临床研究多集中于全身健康的缺牙患者群体,针对T2DM患者群体的临床研究仅限于对其进行即刻种植,或在延期种植后进行即刻修复[12-14],尚缺乏即刻种植即刻修复的相关临床及基础研究。
基于此现状,本研究用新西兰兔的下颌切牙进行即刻种植即刻修复的动物模型构建,通过动物实验初步验证T2DM个体即刻种植即刻修复的可行性及预后特征,并分析其组织学改建特点,希望为T2DM患者进行即刻种植即刻修复的临床试验设计提供参考依据。
(1)实验动物:健康的雄性新西兰兔(西安市迪乐普生物资源开发有限公司)20 只,约12 月龄,体重3~4 kg,分笼饲养于空军军医大学第三附属医院实验动物中心。
(2)仪器与设备:光纤种植机(Nobel,瑞典),Micro-CT扫描仪(西门子Inveon,德国),硬组织磨片机(EXAKT 400CS,德国),Epoch 全波长酶标仪(Bio-Tek,美国),反转录热循环仪(Eppendorf,德国),实时定量 PCR仪(Bio-rad,美国),超速离心机(Eppendorf,德国)。

(1)建立T2DM动物模型:为建立符合T2DM患者病理特征的T2DM动物模型,本研究采用高糖高脂饲料喂养,联合小剂量多次的链脲佐菌素(streptozotocin,STZ)进行动物模型构建。在基础饲料(53%)中加入蔗糖(37%)和猪油(10%)[15],混匀、搅拌、烘干、成型后,应用Co60 辐照灭菌后密封包装保存制作成高糖高脂饲料(西安迪乐普生物资源开发有限公司)。
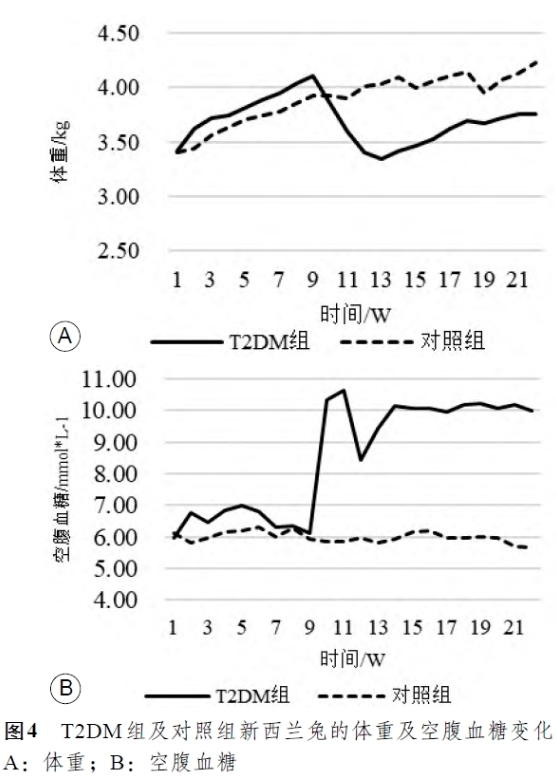
所有新西兰兔(20只)在室温20℃ ±5℃、空气相对湿度55%±10%、12小时交替昼夜节律的环境下,正常适应性喂养1 周。20只新西兰兔随机分为T2DM组(10只)和对照组(10只),对照组继续基础饲料喂养,T2DM组更换高糖高脂饲料喂养。T2DM组饲养的第1 周前3天使用高糖高脂饲料和基础饲料比例为3:7 的混合饲料进行适应性喂养,第1周的4~7天混合饲料的比例更换为1 : 1,第2周完全使用高糖高脂饲料进行喂养,以便于实验兔适应高糖高脂饲料,避免因进食状态不佳影响模型构建。对2 组新西兰兔饲喂8周(自分组进行高糖高脂饲喂之日起计算),喂养期间每周定期进行体重测量和空腹血糖测定,并记录数值。
高糖高脂饲喂8 周后, 对T2DM组的实验兔禁食16 小时以上,避光条件下以65 mg/kg体重耳缘静脉注射低温下(4℃)避光新鲜配制的2% STZ溶液,72 小时再次于空腹16 小时后注射等剂量低温下新鲜配制的STZ溶液。2 次给药后按照高糖高脂饲料喂养1 周,测定空腹血糖,对连续3 次空腹血糖大于7.0 mmol/L的实验兔认定为建模成功,建模失败的T2DM组实验兔1 周后重新给药并测定血糖。将2 次给药周期结束后均失败的T2DM组实验兔排除并判定为建模失败。
建模成功后的实验兔逐日减少高糖高脂饲料的比例,1 周后更换为基础饲料喂养,确定其状况稳定后进行即刻种植即刻修复。
(2) 即刻种植即刻修复及术后维护:实验动物术前8 小时禁食禁水,肌肉注射陆眠宁(0.1 g/mL,0.1 mL/kg体重)镇静后,耳缘静脉推注3%戊巴比妥钠溶液(0.3 mL/kg体重),铺单消毒,下颌切牙区注射0.3 mL盐酸阿替卡因肾上腺素注射液局部麻醉,在避免牙槽骨(尤其是唇侧骨壁)损伤的前提下,牙挺挺松后拔除下颌切牙。生理盐水冷却下,使用种植机对一侧拔牙窝逐级预备窝洞, 在35 N·cm植入扭矩下植入带有光滑颈圈的4.1 mm×12.0 mm软组织水平种植体(Straumann, 瑞士), 光滑颈圈顶部平齐牙槽骨平面,戴螺钉固位临时修复体, 并加力至15 N·cm, 若加力至15 N·cm种植体无松动、唇侧骨板未见明显开裂则判定为手术建模成功。临时修复体使用复合树脂模拟实验兔下颌切牙外形制作后口内戴入,且进行高度抛光。缝合伤口,术区局部注射0.3 mL地塞米松+庆大霉素混合溶液( 地塞米松:5 mg/mL,庆大霉素:40 000 u/mL,注射前1:1混匀),术后即刻肌注0.5 mL 20 000 u/mL庆大霉素。调磨上颌切牙至无咬合接触,术后3 天每天肌肉注射0.5 mL 20 000 u/mL青霉素预防感染。手术过程见图1。
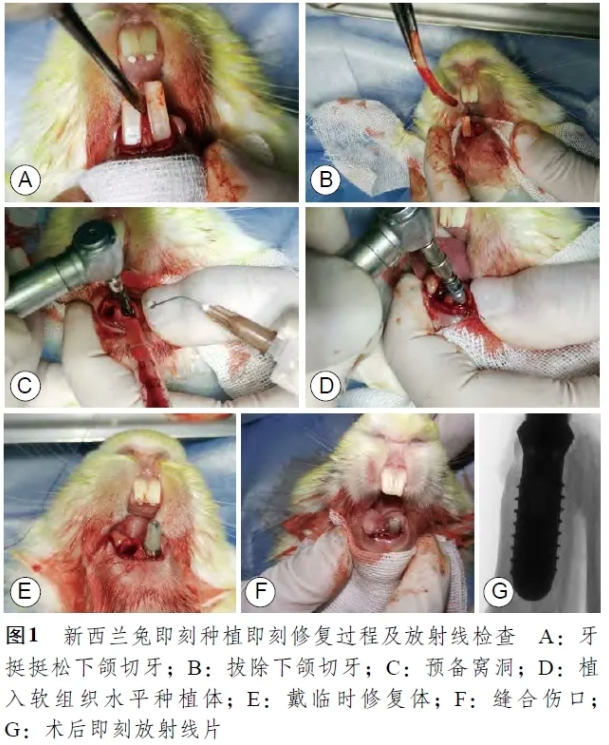
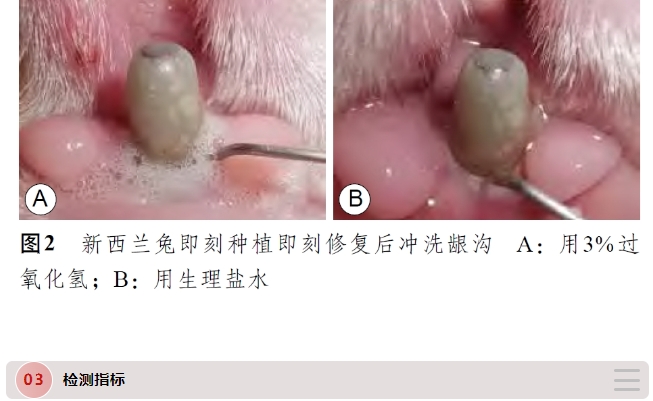
术后每周复查,调磨上颌切牙至无咬合接触,并使用3%过氧化氢和生理盐水交替冲洗(图2)。若局部出现感染迹象(牙龈红肿、探诊触碰出血等),则清理消毒,同时在龈沟内注射盐酸米诺环素软膏,1 周后观察有无好转。若实验兔始终愈合不佳、并出现种植体松动,则判定为种植体失败。口腔种植术后1 个月、2 个月、3 个月随机在T2DM组及对照组内各抽取3 只实验兔处死取材,取材组织为带有种植体的下颌骨部分。
(1)Micro-CT: 将所有样本修剪至25 mm×20 mm×10 mm大小,确保种植体周围骨组织完整性,并彻底去除表面的软组织,使用4%多聚甲醛固定液于4℃条件下固定48 小时以上,Micro-CT高分辨率模式下扫描样本。观察样本与种植体长轴平行的纵切面,然后从种植体光滑颈圈与体部边界开始,将种植体表面向四周扩散。
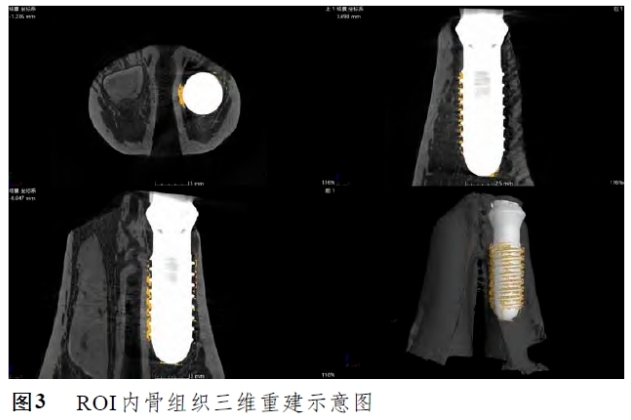
200 μm范围内的骨组织设置为感兴趣区域(region of interest,ROI)。对ROI内种植体周骨组织进行三维重建(图3),并对其状态进行定量分析,主要包括:骨小梁厚度(Tb.Th,μm)、骨小梁间距(Tb.Sp,μm)、骨小梁数量(Tb.N,1/mm)及骨体积分数(BV/TV,%)。
(2)组织切片染色:对2 组样本脱水、浸塑、包埋和硬组织切片,最终打磨样本切片至30~40 μm。所有切片脱塑处理,并对2 组各时间段的样本切片均进行甲苯胺蓝染色及苦味酸- 品红(Van Gieson,VG)染色,用中性树脂封片。
(3)RT-qPCR检测:提取种植体植入后1个月的种植体周软组织样本,并通过RT-qPCR检测相关炎性因子(IL-1β、IL-6、IL-33、TNF-α)RNA来评价T2DM实验兔在进行即刻种植即刻修复后种植体周组织发生炎症的风险与对照组有无显著差异。实验选择GAPDH作为内参进行检测。
(4) 统计学分析: 应用Microsoft Excel2016 建立数据库,SPSS v21.0 软件(IBM,芝加哥)对实验数据进行统计学分析。本实验所有数据均采用均数±标准差形式表示,经过正态性检验确定数据为正态分布后,采用单因素方差进行统计学分析。P<0.05 时,判定该差异存在统计学意义。

1. T2DM即刻种植即刻修复新西兰兔模型构建及血糖监测:
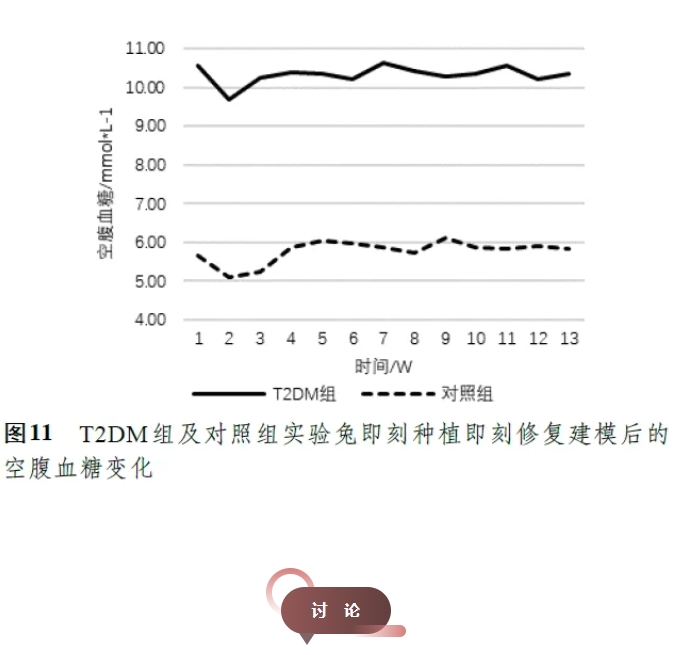
2 组实验兔在T2DM动物模型构建及验证过程中体重及空腹血糖监测结果如图4 所示,T2DM组新西兰兔在高糖高脂饲料喂养期间表现为体重及空腹血糖缓慢增长,而在给药(第9 周)后,因实验兔的胰岛B细胞在小剂量、多次注射STZ后受到破坏,其胰岛素分泌和血糖调节功能受损,空腹血糖明显升高,同时出现体重减轻,多饮、多食、多尿的表现,与T2DM患者发病初期相关体征类似。
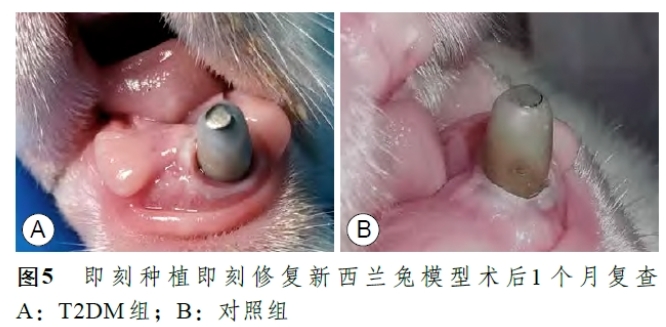
术后2 组实验兔(共20 只,T2DM组与对照组各10 只)在定期应用抗生素的情况下伤口愈合良好,2 组各有1 只实验兔种植体未发生骨结合,判定为种植体失败,2 组实验兔即刻种植即刻修复的种植体留存率均为90%;复查中通过肉眼观察可发现T2DM组实验兔与对照组相比种植体周牙龈袖口相对松弛,角化龈宽度相对不足,同时与对照组相对坚韧的牙龈相比,T2DM组种植体周软组织相对松软红肿,存在疑似炎症表现(图5)。
2. Micro-CT扫描重建的结果分析:
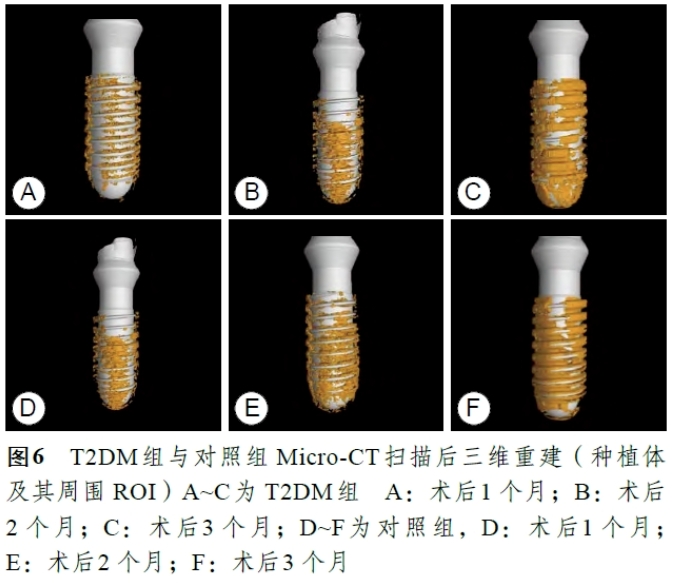
Micro-CT扫描重建的结果如图6 所示, 与对照组相比,T2DM组样本在种植体植入后早期(1 个月、2 个月)种植体周骨质明显少于对照组,而在3 个月种植体周骨质及骨量与对照组基本相近,这提示T2DM组新西兰兔在即刻种植即刻修复后,早期成骨及骨结合较慢,需要延长愈合时间以达到良好的愈后。
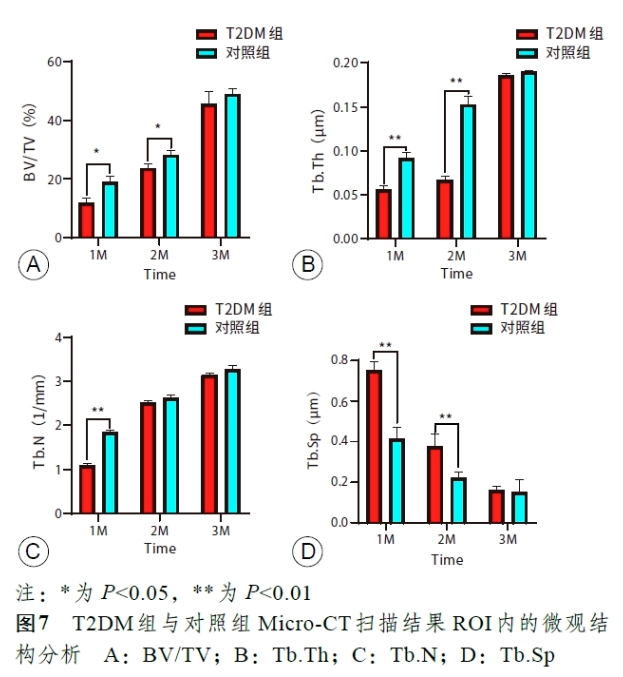
种植体周ROI内微观结构分析的相关结果如图7 所示。术后1 个月,T2DM组Tb.Sp显著高于对照组,BV/TV、Tb.N、Tb.Th均显著低于对照组;术后2 个月,T2DM组Tb.Sp显著高于对照组,BV/TV与Tb.Th显著低于对照组,而Tb.N2 组间并无显著差异;术后3 个月,T2DM组与对照组在评价骨微观结构的各项参数对比中均无显著差异。结果提示T2DM组实验兔在即刻种植即刻修复后早期种植体周骨组织形成上显著低于全身健康实验兔,而在种植体植入后3 个月两者无显著差异。
3. 组织学观察及分析种植体骨结合:
组织学切片分析、测量过程使用Image J软件(national institutes of health,美国)进行,所有数据均测量、计算3遍取平均值。术后1个月所取2组实验兔的样本组织学染色结果如图8A所示。切片甲苯胺蓝染色后可观察到浅蓝色背景下种植体周被染成浅蓝色的骨组织,其中新生牙槽骨的颜色与一直存在的旧骨相比颜色较浅,对比2组切片染色结果可见T2DM组实验兔在即刻种植即刻修复后,新骨形成较慢,且骨质较差,对照组种植体周骨量比T2DM组更多,同时骨小梁更厚、密度更大,其骨质也显著优于T2DM组。对切片甲苯胺蓝染色结果进行骨体积率分析,对比2 组实验兔在即刻种植即刻修复后新生骨的生长情况,结果如图所示,即刻种植即刻修复后的早期(1 个月),T2DM组新生骨形成显著低于对照组(P<0.05),提示T2DM组实验兔术后早期成骨能力差,新生骨形成缓慢,并对骨结合有一定影响;进一步在样本切片VG染色结果中对骨结合率进行分析,镜下可观察到对照组种植体周呈橘红色的骨组织明显较T2DM组多,其骨结合形成情况显著优于T2DM组。对2 组样本硬组织切片的VG染色结果进行骨结合率分析对比后发现, 即刻种植即刻修复后1 个月内T2DM组实验兔的种植体骨结合率显著低于对照组(P<0.01),且种植体周骨量相对较低。

4. RT-qPCR检测种植体周软组织炎性因子:
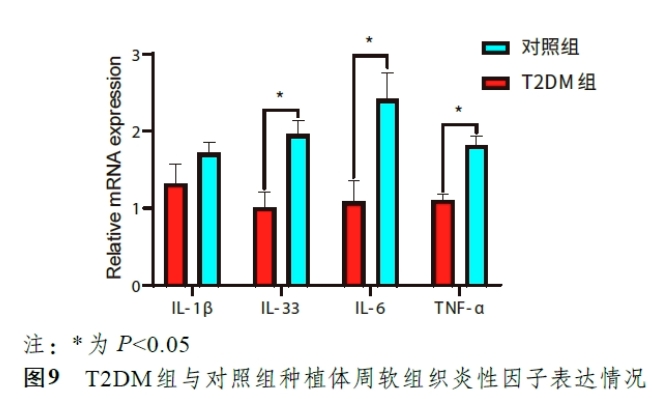
结果:RT-qPCR检测各项主要炎性因子(IL-1β、IL-6、IL-33 及TNF-α)表达情况的结果如图9 所示,T2DM组实验兔在IL-6、IL-33 与TNF-α的表达情况显著高于对照组(P<0.05),但在IL-1β的表达水平上并无显著差异(P=0.066>0.05)。
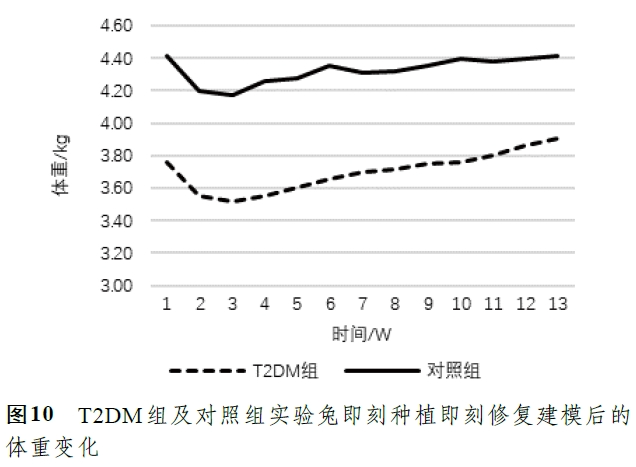
术后体重及空腹血糖检测结果(图10,11)提示,术后早期实验兔因伤口未愈合出现进食不适、体重轻微下降的情况,但在伤口愈合后其体重逐渐恢复正常。
与常规的种植修复治疗不同,即刻种植即刻修复术后种植体骨结合形成与拔牙窝局部牙槽骨愈合同期进行,这一特点常引起超预期的骨改建吸收,进而影响种植修复治疗的预后[16-17];T2DM患者术后种植体骨结合形成缓慢、拔牙窝愈合差等因素可能造成即刻种植即刻修复预后不理想[18-19]。目前的临床研究多集中于T2DM患者延期种植即刻修复[20-22],缺乏T2DM患者即刻种植即刻修复的临床研究报告,少数现有的报告仅局限于个别成功病例[23],缺乏对其预后的系统性评价及分析;由于临床工作的特殊性,临床试验中难以对T2DM患者即刻种植即刻修复后局部种植体骨结合形成、种植体周骨质变化、软组织愈合情况等组织学改建进行更深入的探索。本研究在将即刻种植即刻修复应用于T2DM患者群体之前,先建立相应动物模型初步探索该方案的可行性及预后,为下一步T2DM患者即刻种植即刻修复的临床应用提供参考。因新西兰兔下颌切牙能较好模拟T2DM患者前牙美学区的相关特点,所以本研究选取新西兰兔进行即刻种植即刻修复动物模型的构建。在建模中拔除新西兰兔下颌切牙,即刻植入1 颗4.1 mm×12.0 mm软组织水平种植体,复合树脂制作临时冠即刻修复,并通过多种方法评估预后及组织学改建,为即刻种植即刻修复的动物实验研究提供了新的研究方法,同时为进一步将即刻种植即刻修复应用于T2DM患者的临床研究设计与开展提供参考依据。
本研究中,T2DM组与对照组的种植体留存率均为90%:出现种植体失败的实验兔经检查均为种植体早期未能形成骨结合,考虑可能原因为种植体植入后初始稳定性不足。鉴于啮齿类动物切牙存在持续生长的特性,实验中需要每周对其对颌切牙(上颌切牙)进行调磨以确保其不产生任何咬合接触,并对种植体局部组织愈合情况进行检查。在复查中,2组均出现术后早期伤口开裂或种植体龈沟内探诊出血的个例,但在清理消毒、重新缝合以及冲洗上药(盐酸米诺环素软膏)后均恢复正常。实验结果表明,T2DM组新西兰兔在应用即刻种植即刻修复后可获得与全身健康新西兰兔基本相近的预后,其安全性良好,提示T2DM患者可能具备进行即刻种植即刻修复治疗的可行性。、
T2DM患者由于体内高血糖环境以及免疫激活引起的慢性炎症状态,其成骨细胞活性相对较低,同时破骨细胞活性高导致骨吸收活跃,即刻种植伴随的早期骨吸收在T2DM个体中表现可能更为严重[24-25]。本实验中甲苯胺蓝及VG染色的结果分析提示,T2DM组新西兰兔在即刻种植即刻修复术后早期(1 个月)的成骨能力显著低于健康新西兰兔,其新骨形成较低且种植体骨结合形成缓慢,同时Micro-CT扫描分析结果提示,T2DM组新西兰兔在种植体植入后1个月及2个月的种植体周骨质明显少于对照组,这可能是T2DM个体术后早期成骨能力较低所致;而3个月时2组种植体周骨质及骨量基本相近,提示T2DM个体即刻种植即刻修复后早期成骨能力不足,但后期可以获得与全身健康个体相近的预后。Al Hezaimi等[12]对比格犬注射STZ构建了糖尿病即刻种植的动物模型,研究结果提示糖尿病个体在即刻种植后各项临床指标(种植体颊侧骨厚度、边缘骨高度、种植体骨结合率等)与正常个体相比存在显著差异,主要表现为种植体骨结合形成相对较慢,且边缘骨吸收更大,提示T2DM个体即刻种植后可能存在相关风险。本研究在此基础上对T2DM动物联合应用了即刻修复,相关结论与其结果相近。
目前针对T2DM患者口腔种植的研究均提示T2DM个体成骨能力及种植体骨结合的形成情况与全身健康个体存在差异,主要原因包括:T2DM患者体内过度炎症反应导致IL-1β、IL-6及TNF-α等炎症因子过度表达, 进而影响骨代谢[26-27];患者自身骨髓间充质干细胞(bonemarrow mesenchymal stem cells,BMSCs) 增殖分化能力降低,并且分泌各类成骨关键因子以及合成胶原能力降低[28-29],同时高血糖状态及相关并发症导致损伤血管内皮、促进破骨细胞分化[30]。各类因素的综合作用使得T2DM患者在种植修复治疗中种植体骨结合形成较慢。Sam等[31]的临床研究对比了T2DM患者与全身健康者在常规种植术后早期(8 周)的预后,结果表明,T2DM患者术后早期种植体骨结合率与新骨形成率显著低于全身健康者。本研究的结果与该研究相近,即T2DM个体即刻种植即刻修复后机体早期成骨能力相对较低,种植体骨结合及局部骨愈合速率均显著低于全身健康个体,提示在后续临床研究中应注意T2DM患者术后早期骨结合形成相对缓慢的问题。
受体内高糖环境和机体免疫系统异常的影响,T2DM患者在种植修复治疗中软组织在术后可能会出现比全身健康者更为严重的炎症表现[5]。而本实验术后1 周以上,伤口愈合后常规复查时通过观察发现T2DM组新西兰兔种植体周软组织角化龈宽度相对不足,同时其牙龈袖口结构较为松弛,且牙龈表现出松软、红肿等疑似炎症表现。对此,本实验对软组织的主要炎性因子(IL-1β、IL-6、IL-33、TNF-α)进行RT-qPCR检测,结果显示在所检测的4 种炎性因子的表达中,T2DM组的IL-6、IL-33、TNF-α表达均显著高于对照组。IL-6 及TNF-α是种植体周炎发病前常见的促炎性细胞因子[32],而IL-33 的表达增高多由于组织细胞受到破坏所致,提示T2DM个体术后软组织炎症风险更高。需要注意的是,虽然实验组在IL-1β的表达上高于对照组,但该差异无统计学意义,其原因可能为IL-1β多见于炎症反应的急性期,且表达产物易降解,因此在1 个月取材时2 组实验兔的IL-1β表达均有下降,进而影响了统计学结果[33]。相关研究表明,在种植体周炎方面,T2DM个体的发病风险显著高于健康个体,且与空腹血糖水平成正相关[34]。相关的系统评价与Meta分析提示,T2DM患者延期种植即刻修复可获得与全身健康者相近的预后,良好的血糖控制与口腔卫生清洁可以有效改善T2DM患者即刻修复种植体的愈合状况[13]。因此,T2DM患者即刻种植即刻修复时,应注意软组织的炎症情况,同时关注血糖控制及口腔卫生状况。
综上所述,本实验T2DM组新西兰兔采用软组织水平种植体、螺钉固位进行即刻种植即刻修复,在完全愈合后获得了与全身健康新西兰兔相近的预后,提示T2DM动物模型在严格把控相关因素的前提下,具备即刻种植即刻修复的可行性,为进一步T2DM患者临床试验提供了参考依据;在本研究中,T2DM组新西兰兔在术后早期机体成骨能力差,种植体骨结合与种植体周骨质新生速率显著低于全身健康新西兰兔,同时有着更高的炎症风险。因此,在进一步临床试验中,研究者应注意T2DM患者种植体周软组织的炎症风险。但T2DM动物在即刻种植即刻修复术后早期成骨能力差、骨结合形成缓慢以及存在软组织炎症风险的具体机制仍不明确,需要进一步通过实验研究加以证实。
[1] Alasqah M, Mokeem S, Alrahlah A, et al. Periodontal parameters in prediabetes, type 2 diabetes mellitus, and non-diabetic patients[J]. Braz Oral Res, 2018,32:e81. DOI: 10.1590/1807-3107bor-2018.vol32.0081.
[2] Raju K, Taylor GW, Tahir P, et al. Association of tooth loss with morbidity and mortality by diabetes status in older adults: a systematic review[J]. BMC Endocr Disord, 2021,21(1):205. DOI: 10.1186/s12902-021-00830-6.
[3] Power DJ, Sambrook PJ, Goss AN. The healing of dental extraction sockets in insulin-dependent diabetic patients: a prospective controlled observational study[J]. Aust Dent J, 2019,64(1):111-116. DOI: 10.1111/adj.12669.
[4] Wang F, Song YL, Li DH, et al. Type 2 diabetes mellitus impairs bone healing of dental implants in GK rats[J]. Diabetes Res Clin Pract, 2010,88(1):e7-e9. DOI: 10.1016/ j.diabres.2010.01.017.
[5] 陆添, 吴蔚, 刘敏. Ⅱ型糖尿病患者种植牙二期手术后牙龈愈合状况研究[J]. 健康研究,2017,37(4):417-419,423. DOI: 10.3969/j.issn.1674-6449.2017.04.017.
[6] Arora H, Ivanovski S. Clinical and aesthetic outcomes of immediately placed single-tooth implants with immediate vs. delayed restoration in the anterior maxilla: a retrospective cohort study[J]. Clin Oral Implants Res, 2018,29(3):346-352. DOI: 10.1111/clr.13125.
[7] Alqutaibi AY, Hussain BS, Alobodi AK. Immediate and conventional loading of a single dental implant placed in the esthetic zone may yield comparable clinical outcomes[J]. J Evid Based Dent Pract, 2020,20(4):101492. DOI: 10.1016/ j.jebdp.2020.101492.
[8] Slagter KW, Raghoebar GM, Hentenaar D, et al. Immediate placement of single implants with or without immediate provisionalization in the maxillary aesthetic region: a 5-year comparative study[J]. J Clin Periodontol, 2021,48(2):272- 283. DOI: 10.1111/jcpe.13398.
[9] Shi S, Song S, Liu X, et al. Construction and performance of exendin-4-loaded chitosan-PLGA microspheres for enhancing implant osseointegration in type 2 diabetic rats[J]. Drug Deliv, 2022,29(1):548-560. DOI: 10.1080/10717544.2022.2036873.
[10] Gadicherla S, Smriti K, Roy S, et al. Comparison of extraction socket healing in non-diabetic, prediabetic, and type 2 diabetic patients[J]. Clin Cosmet Investig Dent, 2020,12:291-296. DOI: 10.2147/CCIDE.S264196.
[11] Mitsias M, Siormpas K, Pistilli V, et al. Immediate, early (6 weeks) and delayed loading (3 months) of single, partial and full fixed implant supported prostheses: 1-year post-loading data from a multicentre randomised controlled trial[J]. Eur J Oral Implantol, 2018,11(1):63-75.
[12] Al Hezaimi K, Naghshbandi J, Nooh N, et al. Buccal bone remodeling around immediate implants in STZinduced diabetic dogs: a histologic and microcomputed tomographic analysis[J]. Int J Periodontics Restorative Dent, 2021,41(5):683-690. DOI: 10.11607/prd.4589.
[13] Andrade C, Paz J, de Melo GS, et al. Survival rate and peri-implant evaluation of immediately loaded dental implants in individuals with type 2 diabetes mellitus: a systematic review and meta-analysis[J]. Clin Oral Investig, 2022,26(2):1797-1810. DOI: 10.1007/s00784-021-04154-6.
[14] Ibraheem EMA, Hammad HGH, El-Sisy AME. Comparing marginal bone height changes around immediately and delayed implant-retained mandibular overdentures in controlled diabetic patients: a randomized clinical study[J]. Bull Natl Res Cent, 2019, 43(1):1-8. DOI: 10.1186/s42269- 019-0228-1.
[15] 王宗保, 姚峰, 吴端生, 等. 高糖高脂致家兔糖尿病的实验模型探讨[J]. 中国实验动物学报,2003,11(2):103-106. DOI: 10.3969/j.issn.1005-4847.2003.02.010.
[16] Lagunov VL, Sun J, George R. Evaluation of biologic implant success parameters in type 2 diabetic glycemic control patients versus health patients: a meta-analysis[J]. J Investig Clin Dent, 2019,10(4):e12478. DOI: 10.1111/ jicd.12478.
[17] Al-Shibani N, Al-Aali KA, Al-Hamdan RS, et al. Comparison of clinical peri-implant indices and crestal bone levels around narrow and regular diameter implants placed in diabetic and non-diabetic patients: a 3-year follow-up study[J]. Clin Implant Dent Relat Res, 2019,21(2):247-252. DOI: 10.1111/cid.12712.
[18] Power DJ, Sambrook PJ, Goss AN. The healing of dental extraction sockets in insulin-dependent diabetic patients: a prospective controlled observational study[J]. Aust Dent J, 2019,64(1):111-116. DOI: 10.1111/adj.12669.
[19] Wang F, Song YL, Li DH, et al. Type 2 diabetes mellitus impairs bone healing of dental implants in GK rats[J]. Diabetes Res Clin Pract, 2010,88(1):e7-e9. DOI: 10.1016/ j.diabres.2010.01.017.
[20] Andrade C, Paz J, de Melo GS, et al. Survival rate and peri-implant evaluation of immediately loaded dental implants in individuals with type 2 diabetes mellitus: a systematic review and meta-analysis[J]. Clin Oral Investig, 2022,26(2):1797-1810. DOI: 10.1007/s00784-021-04154-6.
[21] Al Amri MD, Alfarraj Aldosari AM, Al-Johany SS, et al. Comparison of clinical and radiographic status around immediately loaded versus conventional loaded implants placed in patients with type 2 diabetes: 12- and 24-month follow-up results[J]. J Oral Rehabil, 2017,44(3):220-228. DOI: 10.1111/joor.12466.
[22] Al Amri MD, Kellesarian SV, Al-Kheraif AA, et al. Effect of oral hygiene maintenance on hba1c levels and peri-implant parameters around immediately-loaded dental implants placed in type-2 diabetic patients: 2 years follow-up[J]. Clin Oral Implants Res, 2016,27(11):1439-1443. DOI: 10.1111/ clr.12758.
[23] Juncar RI, Precup AI, Juncar M. Immediate implantprosthetic dental rehabilitation of patients with diabetes using four immediately loaded dental implants: a pilot study[J]. J Int Med Res, 2020,48(3):300060519897195. DOI: 10.1177/0300060519897195.
[24] 王力锋, 方开秀, 许晓茹, 等. 2 型糖尿病大鼠颅骨极限骨缺损的实验研究[J]. 实用口腔医学杂志,2015,(2):157- 161. DOI: 10.3969/j.issn.1001-3733.2015.02.02.
[25] Yang M, Xie J, Lei X, et al. Tubeimoside I suppresses diabetes-induced bone loss in rats, osteoclast formation, and rankl-induced nuclear factor-κB pathway[J]. Int Immunopharmacol, 2020,80:106202. DOI: 10.1016/ j.intimp.2020.106202.
[26] Akram Z, Rahim ZH, Taiyeb-Ali TB, et al. Resistin as potential biomarker for chronic periodontitis: a systematic review and meta-analysis[J]. Arch Oral Biol, 2017,73:311-320. DOI: 10.1016/j.archoralbio.2016.08.016.
[27] Zhang Y, Jia R, Zhang Y, et al. Effect of non-surgical periodontal treatment on cytokines/adipocytokines levels among periodontitis patients with or without obesity: a systematic review and meta-analysis[J]. BMC Oral Health, 2023,23(1):717. DOI: 10.1186/s12903-023-03383-3.
[28] Sun R, Liang C, Sun Y, et al. Effects of metformin on the osteogenesis of alveolar BMSCs from diabetic patients and implant osseointegration in rats[J]. Oral Dis, 2022,28(4):1170-1180. DOI: 10.1111/odi.13808.
[29] Wang X, Jiang L, Shao X. Association analysis of insulin resistance and osteoporosis risk in chinese patients with T2DM[J]. Ther Clin Risk Manag, 2021,17:909-916. DOI: 10.2147/TCRM.S328510.
[30] King S, Klineberg I, Levinger I, et al. The effect of hyperglycaemia on osseointegration: a review of animal models of diabetes mellitus and titanium implant placement[J]. Arch Osteoporos, 2016,11(1):29. DOI: 10.1007/s11657-016-0284-1.
[31] Sam L, Chattipakorn S, Khongkhunthian P.Osseointegration of maxillary dental implants in diabetes mellitus patients: a randomized clinical trial human histomorphometric study[J]. Appl Sci, 2020, 10(19):6762. DOI: 10.3390/app10196762.
[32] Yu T, Acharya A, Mattheos N, et al. Molecular mechanisms linking peri-implantitis and type 2 diabetes mellitus revealed by transcriptomic analysis[J]. PeerJ, 2019,7:e7124. DOI:10.7717/peerj.7124.
[33] Guzeldemir E, Gunhan M, Ozcelik O, et al. Interleukin-1 and tumor necrosis factor-alpha gene polymorphisms in turkish patients with localized aggressive periodontitis[J]. J Oral Sci, 2008,50(2):151-159. DOI: 10.2334/ josnusd.50.151.
[34] Mokeem S, Alfadda SA, Al-Shibani N, et al. Clinical and radiographic peri-implant variables around short dental implants in type 2 diabetic, prediabetic, and non-diabetic patients[J]. Clin Implant Dent Relat Res, 2019,21(1):60-65. DOI: 10.1111/cid.12691.
















 扫一扫 关注我们
扫一扫 关注我们