
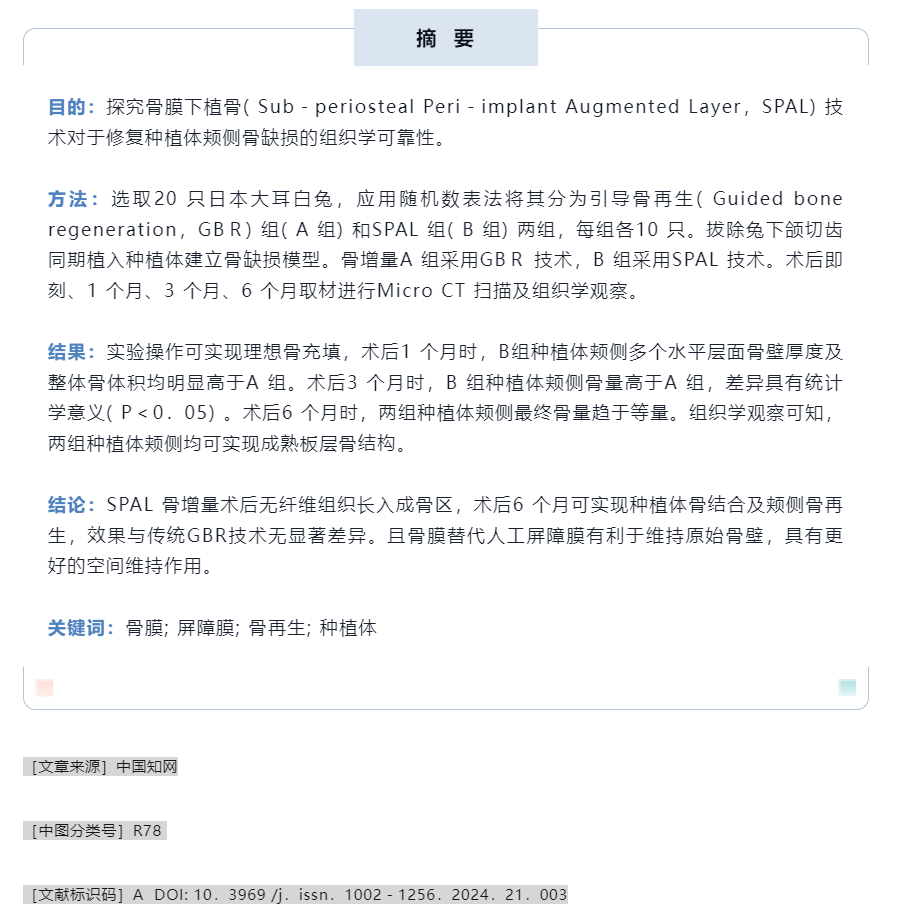



③植入种植体及骨增量: 于拔牙窝内手动旋入实验用种植体,至种植体平台水平高于颊侧牙槽嵴顶约2 mm,即种植体颊侧冠方2 mm 处暴露在骨壁之外,舌侧完全位于骨壁内,如图1F ~ H。实验组的骨增量操作:首先,使用两把镊子分别加持颊侧黏骨膜瓣的近远中冠方边缘,稍微用力提起黏骨膜瓣可形成口袋状。将Bio-Oss 小颗粒骨移植材料用氯化钠注射液浸湿后覆盖于种植体颊侧,并严密充满颊侧黏骨膜瓣所形成的口袋,如图1I。再将颊侧黏骨膜瓣与舌侧瓣拉拢对位缝合。对照组的骨增量操作为: 先根据两颗切齿颊侧骨壁的尺寸和形状修剪Bio-Gide 可吸收生物胶原膜,保证长度足够覆盖牙槽嵴顶及舌侧。使用15c 刀片轻轻划断颊侧黏骨膜瓣偏根方的骨膜组织,避免割断全层组织,此时可见少量出血,如图1J。将修剪合适的生物胶原膜插入口袋状的黏骨膜瓣内侧,血液浸透胶原膜根方,使其与黏骨膜瓣的根方贴合,冠方仍保持干燥直立,如图1K。同样将Bio-Oss小颗粒骨移植材料用氯化钠注射液浸湿后覆盖于种植体颊侧,并严密充满颊侧黏骨膜瓣所形成的口袋,如图1L。此时将生物胶原膜向舌侧反折,完全覆盖牙槽嵴顶后插入到舌侧黏骨膜瓣内,再使用氯化钠注射液润湿,使之贴合,如图1M。将颊侧黏骨膜瓣与舌侧瓣拉拢对位缝合,如图1N。
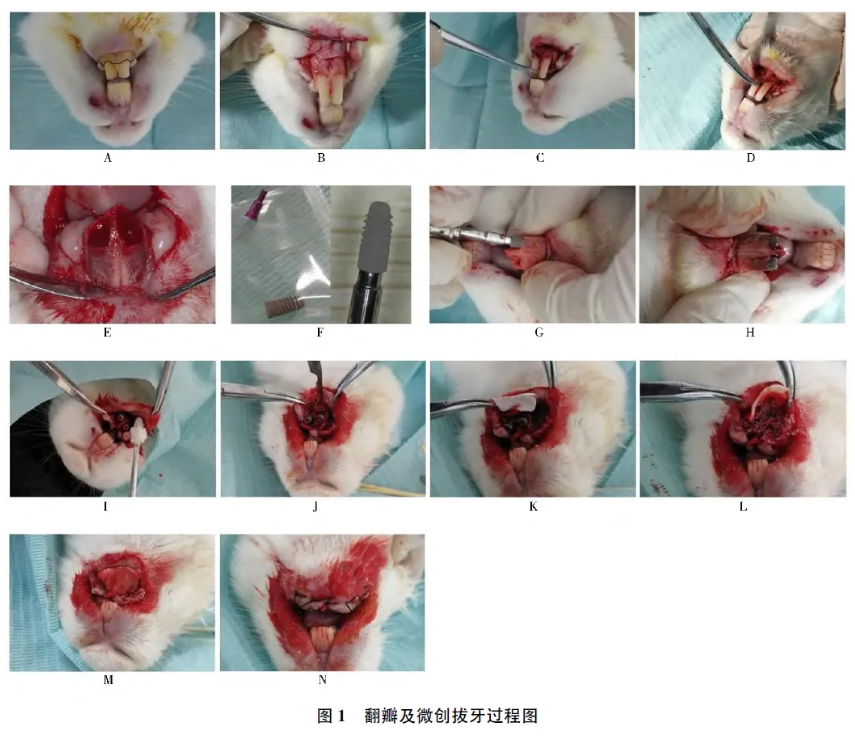



10 倍物镜采集切片全图,种植体、颊舌侧骨壁及软组织均完整可见。术后1 个月A 组: 种植体颊侧附着有新生编织骨结构,内部骨细胞排列不规则,少量成骨细胞可见,如图2A、B。B组: 种植体颊侧覆盖大量淋巴细胞,其外表面为原宿主板层骨结构,如图2C~E。术后3 个月A 组: 种植体颊侧新生编织骨组织中骨细胞排列规则程度提高,如图3A、B。B 组: 种植体颊侧附着新生编织骨,骨细胞排列均较为紊乱,如图3C、D。术后6 个月A、B 两组均可见种植体颊侧粉色成熟板层骨结构,如图4A~D。

早在1925 年,Blaisdell 发表了一篇经典文章,首次将骨膜描述为一个具有两层结构的组织[13]。现在我们更详细地知道骨膜是一种薄而坚韧的结缔组织,通过Sharpey 纤维固定在骨面上。通常,我们将骨膜分为浅表的纤维层和深面的生发层。纤维层,顾名思义富含网状结构的胶原纤维束和成纤维细胞,占骨膜总体积结构比例较大[14]。纤维层为肌腱和韧带提供附着点,从而还起到了结构支持和稳定作用。生发层位于纤维层内侧,与骨外表面接触。虽然生发层较薄且疏松,但其中含有丰富的血管和细胞。其细胞成分包括未分化的间充质干细胞、骨祖细胞、成骨细胞、破骨细胞,成纤维细胞和血管周细胞[15]。从组织学结构来看,纤维层为骨膜组织提供营养及支持,而生发层是骨膜发挥生理功能的结构,其中未分化的间充质细胞在成骨过程中起到了关键作用,它们有助于骨的生长、愈合和修复再生[16]。另外,骨膜血管不仅为骨膜提供营养,还参与骨膜的成骨活动。由于骨膜血管密度高,骨膜内含有丰富的血管周细胞( pericyte) ,即与毛细血管内皮细胞有物理接触的细胞[17]。血管周细胞具有一定分化潜能,在骨膜成骨的过程中,能够分化为成骨细胞[18],作为生发层细胞的补充来源[5, 11]。
骨的发生有两种方式,软骨内成骨和膜内成骨[19-20]。这种成骨机制的差异主要与不同解剖部位的组织性质有关,长骨的形成依靠软骨内成骨方式,而颅面骨的形成以及骨的改建过程多依靠骨膜内成骨方式[21]。血供和氧含量在一定程度上也影响着骨膜成骨的方式。当血供、氧气充足时,间充质干细胞分化为成骨细胞,发生膜内成骨; 血供不足则导致细胞迅速增殖形成软骨而不是骨[22]。膜内成骨过程还会因骨膜结构被扰乱而诱导形成软骨。Girgis等[23]在刮除大鼠顶骨骨膜后制造骨折模型,结果发生了软骨愈合。Uddstromer 等[24]将锐性分离得到的骨膜移植到三种不同的肌肉组织中,全都实现了异位成骨。而将肋骨骨膜生发层剥离“撕下”后再用于修复胫骨缺损,未能发生成骨。这说明利用骨膜成骨时,保证骨膜的完整性至关重要[25]。保证骨膜生发层的完整,间充质细胞才能分化出成骨细胞,继而形成新骨。
GBR是目前口腔种植临床中最常用的骨增量术式。GBR的原理是通过屏障膜建立一个隔离的空间,使骨组织在一个无干扰、受保护的条件下发挥其自然愈合能力。然而,人工屏障膜的放置也在一定程度上阻隔了骨膜与植骨区域的血供和细胞交通。另一方面,GBR术中为了实现创口的无张力关闭,需要离断颊侧瓣的骨膜层进行减张,这一操作破坏了骨膜结构的完整性,损伤了骨膜生发层。这些因素都使得骨膜的成骨潜能在GBR术式中得不到充分利用。
SPAL 技术利用完整的骨膜来容纳并覆盖骨移植材料从而修复种植体颊侧骨缺损。该术式与传统GBR的核心区别在于保证骨膜完整性且不使用人工屏障膜。骨膜表面富含粗大的胶原纤维束,完全可以阻挡纤维组织的过早长入[26],代替了人工膜的机械屏障作用,为骨组织生长提供充足时间。更关键的是,骨膜生发层能够对骨的修复性再生过程提供血供支持和丰富的细胞成分。骨膜的成骨潜能会因手术创伤而被激活,各种细胞因子、生长因子等可以刺激骨膜衍生细胞的增殖和血管的新生,从而实现成骨[27-28]。在Trombelli 的临床研究中15 个种植体颊侧存在骨缺损的位点,经SPAL 骨增量后愈合3~4个月, 80%的位点达到了完全骨充填,且种植体颊侧骨壁厚度平均为3.1 mm; 12 个种植体颊侧骨壁厚度小于1 mm 的位点,术后90%实现了大于1.5 mm 的临床临界值。
本研究为骨膜引导成骨修复种植体颊侧骨缺损进行了组织学验证。首先,该动物模型的建立基本符合实际临床情况,且两种术式的各自要点都分别进行了还原。因此,可以说该动物模型的建立是成功的。第二,术后观察时间节点的设置分别对应骨再生过程所遵循的骨生长和发育的模式。1 个月时,编织骨可以成为薄的、分支状的板层结构,其中的血管网已连接成熟。由前已知,血管形成和充足的血供对于骨的发生和维持都极其重要[29]。因此术后1个月作为一个重要的观察时间节点,以评价该板层结构的质和量。最初的分支状编织骨支架可作为板层骨沉积的模板,在术后3~4 个月时,转化为皮质骨和规则松质骨。此时间节点的设置可评价相对成熟的板层骨的质和量。在术后第4 个月的时间里,皮质骨将完成哈弗系统的改建,从而完成最终成熟。从第4 个月末或第5 个月初时,随着皮质骨板的形成,骨再生的塑形过程将重新开始[30]。因此术后6个月时,皮质骨将清晰可辨,骨小梁结构排列更加紧密,以此作为术后的最终观察时间节点。且临床中GBR术后的常规愈合周期为6 个月,二期手术打开时可见成骨完全。这三个观察时间节点的设置分别对应骨再生过程所遵循的骨生长和发育的模式。
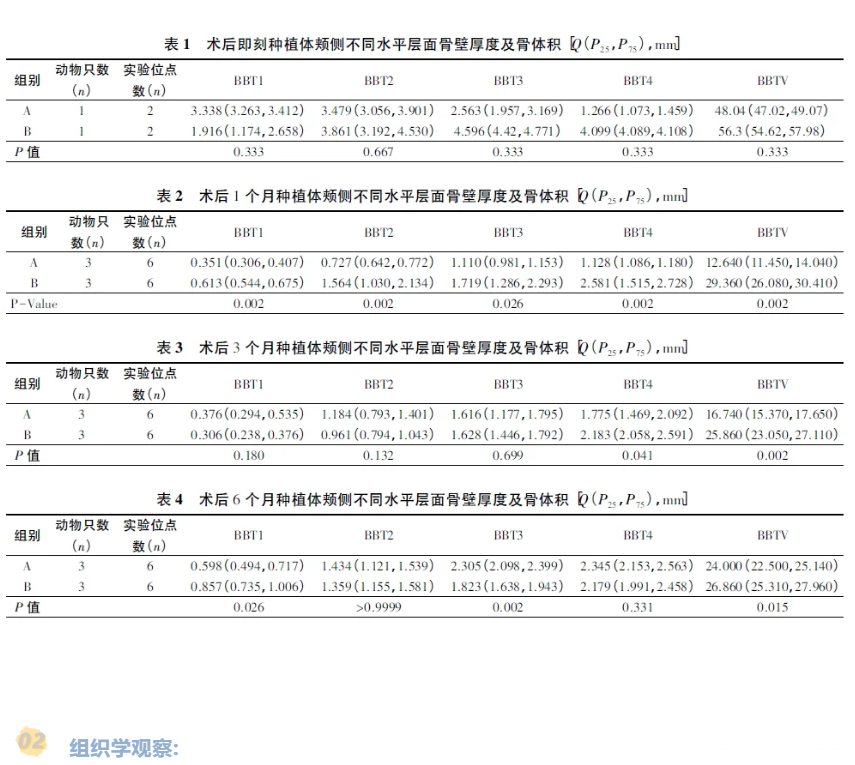
分析Micro CT 测量数据发现在第一个月的愈合期里两组种植体颊侧骨壁厚度及骨体积均大幅度下降,主要与原宿主颊侧骨壁的吸收有关。手术创伤会诱导急性炎症反应,形成大量破骨细胞吞噬颊侧束状骨[31]。然而此时B 组种植体颊侧多个水平层面骨壁厚度及整体骨体积均明显高于A 组。结合同时期组织切片结果,在B 组中种植体颊侧硬组织主要为原宿主骨壁,而A 组均为紫色新骨。可以说明术后早期阶段骨膜对原宿主骨壁的保护减少了骨吸收。B 组骨膜瓣充足的血运可快速重建颊侧骨壁的血液循环,维持原宿主骨壁中骨细胞的活性。充足的血供在一定程度上还能够提高局部骨组织的抗感染能力,避免存活的骨细胞被吸收[32]。相比于A 组中生物胶原膜对血供的隔离,B 组在一定程度上实现了对原宿主骨量的维持。在修复性骨再生方面,骨膜直接接触骨增量区域是具有更好的诱导成骨效果的。第一,覆盖在成骨区表面的骨膜表层纤维层中粗大的纤维束交织成网[3],成功地隔离了颊侧软组织的优先长入,为成骨细胞的进入争取了时间和空间。并且纤维层作为根方肌腱的附着点起到了结构支持和稳定作用,为成骨区域提供了无干扰、受保护的环境。第二,骨膜深层的生发层直接覆盖成骨区域,为成骨区域提供了丰富的间充质干细胞和血管周细胞,这些细胞能够在细胞因子和生长因子的刺激下分化成为骨祖细胞。与此同时,骨膜内侧丰富的血管成分为成骨区域带去了充足的氧气、血供和各种生物因子。在合适的条件下,膜内成骨程序启动[17, 20],骨祖细胞快速直接分化为成骨细胞,从而能够实现成骨细胞的大量生成并发挥生理功能分泌类骨质。而生物胶原膜在阻隔软组织长入的同时,在一定程度上也阻碍了骨膜生发层中天然的血管源性细胞和骨源性细胞的进入,不利于成骨细胞的形成。
术后3 个月时虽然在各个水平层面上两组种植体颊侧骨壁厚度并无差异,但总的骨壁体积B 组仍高于A 组,说明B 组中骨膜维持骨增量空间的能力要强于生物屏障膜。GBR的原理核心在于要建立一个隔离的空间,使骨组织在一个无干扰、受保护的条件下发挥其自然愈合能力。我们知道,骨膜坚韧的纤维层为肌腱和韧带提供附着点,从而能够起到结构支持和稳定作用。且当骨膜受到应力作用时,其纤维弹性组织受牵拉会离开或靠近生发层[33],这种位移改变会影响成骨细胞的生理活性,在细胞水平上引起动态微环境的改变。合适的应力能够提高骨膜组织中骨源性和血管源性生长因子的表达,使间充质干细胞向成骨细胞发展,在早期阶段加强成骨细胞分化作用[34]。Schmidt 等[35]在兔下颌骨骨膜下安置牵张装置将骨膜牵开,一段时间后组织学观察发现有大量成骨细胞、胶原纤维生成,并有较多骨基质沉积,骨膜牵张成骨首次得到了组织学上的证明。
术后6 个月时,两组种植体颊侧最终骨量趋于等量。这说明愈合后期A 组也可以生成与B 组等量的编织骨支架结构。骨膜在编织骨向成熟的皮质骨和规则的松质骨结构转化的过程中并未显示出特别的优势。术后3 个月时,B 组呈现出较为活跃的骨再生状态,新生编织骨成熟度较低,而此时A 组基本完成了编织骨形成,已经开始向成熟板层骨转化。即B 组成骨进程晚于A 组,这可能与早期阶段复杂的应激反应程序有关。B 组术后1 个月时种植体表面出现大量淋巴细胞浸润,首先可以排除感染因素,其次,由于后期B 组发生了种植体骨结合及颊侧骨再生,所以不排除术后1 个月时的炎症反应属于积极现象,淋巴细胞的大量生成或许是自噬机制被激活后促进炎症过程的表现[36-38]。真核细胞在应激状态下会启动自噬机制,改变细胞的功能及代谢[39]。研究表明,自噬过程可以促进成骨细胞的分化,维持骨细胞的生存。还可以降低破骨细胞数量,抑制破骨细胞分化,并且能减弱其骨吸收作用[40]。以上这些作用对于新骨生成和原宿主颊侧骨壁的保留都具有积极作用,但要确定B 组中炎症反应是否与自噬相关还需要进一步的细胞学、分子生物学的研究。术后6 个月的组织切片结果表明A 组和B 组最终均实现了种植体骨结合和颊侧骨再生。在愈合后期主要完成的是哈弗系统的改建和骨再生的塑形过程,最终两组形成的成熟新骨骨量是相同的。这与目前临床已完成的病例结果相吻合。
应用SPAL 技术的愈合期间无纤维组织长入成骨区,术后6 个月可实现种植体骨结合及颊侧骨再生,效果与放置屏障膜的GBR技术无显著差异。且骨膜替代人工屏障膜有利于维持原始骨壁,且具有更好的空间维持作用。

[1] Merheb J,Quirynen M,Teughels W. Critical buccal bone dimensions along implants[J]. Periodontol,2000,2014,66 ( 1) :97-105.
[2] Nevins M,Camelo M,De Paoli S,et al.A study of the fate of the buccal wall of extraction sockets of teeth with prominent roots[J].Int J Periodontics Restorative Dent,2006,26( 1) : 19-29.
[3] Favero G,Botticelli D,Rea M,et al. Influence of presence or absence of teeth adjacent to implants installed immediately into extraction sockets on peri - implant hard tissue levels: an experimental study in the dog[J].Clin Oral Implants Res,2013,24( 3) : 262-269.
[4] Spray JR,Black CG,Morris HF,et al. The influence of bone thickness on facial marginal bone response: stage 1 placement
through stage 2 uncovering[J].Ann Periodontol, 2000,5( 1) : 119-128.
[5] Buser D,Martin W,Belser UC. Optimizing esthetics for implant restorations in the anterior maxilla: anatomic and surgical considerations[J].Int J Oral Maxillofac Implants,2004,19 Suppl:43-61.
[6] Grunder U,Gracis S,Capelli M. Influence of the 3-D bone-toimplant relationship on esthetics[J].Int J Periodontics Restorative Dent, 2005,25( 2) : 113-119.
[7] Merheb J,Quirynen M,Teughels W. Critical buccal bone dimensions along implants[J].Periodontol,2014,6 6( 1) : 97-105.
[8] Merheb J,Vercruyssen M,Coucke W, et al.The fate of buccal bone around dental implants.A 12-month postloading follow-up study[J].Clin Oral Implants Res,2017,28( 1) : 103-108.
[9] Monje A,Chappuis V,Monje F,et al. The Critical Peri-implant Buccal Bone Wall Thickness Revisited: An Experimental Study in the Beagle Dog[J].Int J Oral Maxillofac Implants,2019,34( 6) :1328-1336.
[10] 徐丽娜,王琛.GBR技术与种植相关的研究进展[J]. 口腔医学, 2017, 37( 9) : 829-832+840.
[11] Dimitriou R,Mataliotakis GI,Calori GM,et al.The role of barrier membranes for guided bone regeneration and restoration of large bone defects: current experimental and clinical evidence[J].BMC Med, 2012,10: 81.
[12] Trombelli L,Severi M,Pramstraller M, et al.A simplified soft tissue management for peri - implant bone augmentation[J]. Int J Oral Maxillofac Implants,2019,34( 1) : 197-204.
[13] Lin Z,Fateh A,Salem DM,et al. Periosteum: biology and applications in craniofacial bone regeneration[J]. J Dent Res,2014, 93( 2) : 109-116.
[14] 宫敏.基于静电纺丝的仿生型人工骨膜及柔性电子器件的设计、制备与应用研究[D].北京化工大学,2019.
[15] 宋守礼,朱盛修.骨膜的组织学特征和超微结构[J].中华骨科杂志,1996( 6) : 60-62.
[16] Zhang X,Awad HA,O'keefe RJ,et al.A perspective: engineering periosteum for structural bone graft healing[J].Clin Orthop Relat Res, 2008,466( 8) : 1777-1787.
[17] 刘伟.下颌骨体部外板截除术骨膜因素对幼龄猪下颌骨形态学与组织学的影响[D].北京协和医学院,2012.
[18] Bianco P,Riminucci M,Gronthos S,et al. Bone marrow stromal stem cells: nature,biology,and potential applications[J]. Stem Cells,2001,19( 3) : 180-192.
[19] Youn I,Suh JK,Nauman EA,et al. Differential phenotypic characteristics of heterogeneous cell population in the rabbit
periosteum[J].Acta Orthop,2005, 76( 3) : 442-450.
[20] Verdugo F,D ' addona A,Ponton J. Clinical,tomographic,and histological assessment of periosteal guided bone regeneration with cortical perforations in advanced human critical size defects[J].Clin Implant Dent Relat Res,2012,14( 1) : 112-120.
[21] Lana-Elola E,Rice R,Grigoriadis AE, et al.Cell fate specification during calvarial bone and suture development[J].Dev Biol,2007,311( 2) : 335-346.
[22] Zakaria O,Madi M,Kasugai S.Induced osteogenesis using a new periosteal distractor[J]. J Oral Maxillofac Surg,2012,70 ( 3) : e225-e234.
[23] Girgis FG,Pritchard JJ.Experimental production of cartilage during the repair of fractures of the skull vault in rats[J]. J Bone Joint Surg Br, 1958, 40-B( 2) : 274-281.
[24] Uddstromer L,Ritsila V.Osteogenic capacity of periosteal grafts.A qualitative and quantitative study of membranous and tubular bone periosteum in young rabbits[J]. Scand J Plast Reconstr Surg,1978,12( 3) : 207-14.
[25] 康文岩,赵志英.颌骨骨膜成骨的机制及临床应用[J].内蒙古医学杂志,2015,47( 5) : 566-569.
[26] Mizuno H,Hata K,Kojima K,et al. A novel approach to regenerating periodontal tissue by grafting autologous cultured
periosteum[J].Tissue Eng, 2006,12( 5) : 1227-335.
[27] Bisseret D,Kaci R,Lafage - Proust MH,et al. Periosteum:characteristic imaging findings with emphasis on radiologic -pathologic comparisons[J]. Skeletal Radiol,2015,44 ( 3) : 321-338.
[28] Malizos KN,Papatheodorou LK. The healing potential of the periosteum molecular aspects[J].Injury,2005, 36( Suppl 3) : S13-19.
[29] Quilligan G. 20 years of guided bone regeneration in implant dentistry,2nd edition[J].Br Dent J,2010,209( 4) : 192.
[30] Schenk RK,Buser D,Hardwick W R, et al.Healing pattern of bone regeneration in membrane-protected defects: a histologic study in the canine mandible[J]. Int J Oral Maxillofac Implants,1994,9( 1) : 13-29.
[31] Araujo MG,Lindhe J.Dimensional ridge alterations following tooth extraction. An experimental study in the dog [J]. J Clin Periodontol,2005,32( 2) : 212-218.
[32] 严佐发,苏云,马彦明,等.带蒂胫前骨膜瓣联合自体骨治疗距骨缺血坏死的疗效分析[J]. 实用骨科杂志,2018,24 ( 12) :1082-1084.
[33] Yin X,Zhang C,Hze - Khoong E,et al. Influence of periosteal coverage on distraction osteogenesis with dental implant distractors[J].J Oral Maxillofac Surg,2014, 72( 10) : 1921-1927.
[34] Martinez-De La Cruz G,Yamauchi K,Odajima K, et al.Histologic and histomorphometric evaluation of the bone regeneration following cortical bone repositioning in a rabbit mandible[J].Clin Implant Dent Relat Res,2019, 21( 4) : 613-620.
[35] Schmidt BL,Kung L,Jones C,et al. Induced osteogenesis by periosteal distraction[J]. J Oral Maxillofac Surg,2002,60( 10) : 1170-1175.
[36] 连璐雅,朱海华.自噬对炎症性牙槽骨吸收作用的研究进展[J].中国临床新医学,2020,13( 8) : 833-836.
[37] Cohen M,Guo E,Pucchio A,et al. Maternal obesity reduces placental autophagy marker expression in uncomplicated pregnancies[J].J Obstet Gynaecol Res,2020, 46( 8) : 1282-1291.
[38] 倪一峰.CCN2 和JAK2 信号通路通过自噬促进炎症环境中成骨细胞生存的实验研究[D].武汉: 武汉大学,2020.
[39] Lim YM,Lim H,Hur KY,et al. Systemic autophagy insufficiency compromises adaptation to metabolic stress and facilitates progression from obesity to diabetes[J]. Nat Commun,2014,5:4934.
[40] Cejka D,Hayer S,Niederreiter B,et al. Mammalian target of rapamycin signaling is crucial for joint destruction in experimental arthritis and is activated in osteoclasts from patients with rheumatoid arthritis[J]. Arthritis Rheum,2010,62 ( 8 ) : 2294-2302.
 扫一扫 关注我们
扫一扫 关注我们