

背景:
在骨外科手术的临床应用中,肌腱/韧带断裂通常通过肌腱/韧带重建术来治疗。在该重建术中,断裂的肌腱/韧带末端通常使用传统实心金属螺钉固定,然而由于实心螺钉的应力屏蔽和术后松动问题,使得其对肌腱/韧带末端的长期固定效果非常有限。随着增材制造技术的发展,一系列多孔拓扑结构被发现能够额外应用于传统实心金属螺钉中。通过在实心螺钉中引入合适的增材制造多孔拓扑结构,可以有效地避免螺钉内应力屏蔽的发生,并且随着骨与肌腱/韧带组织逐渐再生长入螺钉的孔隙中,螺钉术后松动的风险能得到显著降低。本研究的主要目的是通过一系列生物实验,探究针对骨与肌腱/韧带组织再生的优势拓扑结构,从而为提高肌腱/韧带重建术螺钉的长期固定效果提供较为可行的一种拓扑优化方案。
方法:
采用 Mathematica 软件设计了Fischer-Koch S、Octet、Diamond、Double Gyroid 四种增材制造多孔拓扑结构下的多孔螺钉,并采用电子束熔化(EBM)三维打印机进行螺钉的打印与制造。初步测试该四种螺钉的力学性能(von Mises 应力分布、杨氏模量、名义屈服强度),并在此之后针对该四种多孔螺钉进行了一系列的体外和体内实验,从而探索这几种螺钉在成骨和肌腱/韧带生成方面各自的生物学功能,并最终筛选出4 种孔形结构中成骨与成肌腱/韧带性能最为优良的一种。
结果:
与实心螺钉相比,这4 种增材制造拓扑优化多孔螺钉均表现出更好的力学性能。在后续的生物实验中发现,设计成Fisher-Koch S 多孔结构的螺钉在促进骨再生方面更具效果,而设计成Octet 多孔结构的螺钉在促进肌腱/韧带再生方面表现出更大的潜力。
结论:
与传统的实心设计相比,增材制造多孔拓扑结构具有力学与生物学上的诸多优点,当其被应用于肌腱/韧带重建术螺钉内时,能够有效提升螺钉植入后的长期固定效果。随着多孔结构的引入,螺钉模量降低到骨小梁组织的合理值范围内。此外,多孔组织结构可以为再生骨和肌腱/韧带组织的原位长入和整合带来更多的孔隙空间,螺钉对肌腱/韧带末端的固定效果和固定强度将显著提升。在这四种结构中,Fischer-Koch S 结构被发现对骨再生更有效,Octet 结构被证明更适合改善肌腱/韧带再生。基于这些发现,提出了Fischer-Koch S-Octet 双层螺钉结构,该结构可用于肌腱/韧带重建术螺钉的拓扑优化,并有效提高螺钉的长期固定效果。
关键词:
增材制造,拓扑优化,骨,肌腱/韧带,螺钉

1.1 肌腱/韧带组织的结构基础肌腱与韧带是人体运动系统的重要组成部分,广泛分布于人体的运动关节区域。肌腱连接着运动肌肉以及骨骼,传导来自肌肉的牵拉力,发挥着引起关节产生运动的关键功能,如肩袖肌腱、髌腱、跟腱等;韧带连接着相邻的两块骨骼,一般起到固定连接关节的作用,如关节侧副韧带、前后交叉韧带、棘间韧带等。肌腱和韧带在组织结构和成分上具有高度的相似性,被认为具有高度的组织同源性,且在人体关节运动中承受着轴向的应力,容易在剧烈的暴力下发生断裂,产生一个亟待手术修补连接的相似断端。肌腱和韧带主体都是由胶原纤维构成的,且胶原纤维由规则的特殊轴向层级结构组成。胶原纤维最基本结构单位是I 型胶原分子,它首先以5 个成簇的形式扭曲形成微纤丝,即最基础的纤维束结构。接下来,大的微纤丝束沿着肌腱或韧带轴向进行平行的空间重复,从而形成了次级纤维束结构--原纤丝。原纤丝的直径约为100-500 纳米,具体的粗细则取决于它所包含的微纤丝的数量的多少。然而不管原纤丝具体的粗细为多少,其均具有相似的内部结构,在电子显微镜下观察,可以发现所有的原纤丝内部均具有相同周期性的分子结构--D 带。D 带沿原纤丝每隔67 nm 的空间距离出现一次,该结构可以从侧面反映微纤丝在原纤丝内是彼此富有规律地分布与结合,具有空间的周期性[1]。接下来,通过包括蛋白聚糖在内的各种生物分子的作用,许多原纤丝彼此进行交联,并一齐被初级内膜包裹,形成了一个大的胶原纤维分子。若干数目的胶原纤维分子被次级内膜包裹形成纤维束,而后若干数目的纤维束被肌腱/韧带外膜包裹最终形成完整的肌腱/韧带组织结构[2, 3]。在肌腱/韧带内,胶原纤维分子之间以及纤维束之间均具有一定的活动度,包裹它们的膜鞘彼此自由接触并不粘连为整体,这使得胶原纤维和纤维束原则上可以轻微移动和横向滑动[1-5]。在组织学层面上,肌腱/韧带内的营养血管网主要分布在外膜和次级内膜上,血管周围偶尔可伴有微小的神经和淋巴管毛细血管,这些微血管神经在中央的深部区域内则很少能观察[3, 5, 6]。这些微血管的平均直径很小,血液流经它们的速度非常慢。这些组织学证据表明肌腱/韧带的总血容量相比于其他组织(如皮肤或肌肉组织)要低得多,并且其内部的营养物与废物物的交换主要依赖于组织基质的扩散途径,这不足以满足细胞旺盛代谢的需要。在细胞加速生长、增殖或分化的过程中,这种营养缺乏现象可能更为严重。因此,上述解剖特征导致肌腱/韧带内部受限的营养交换可以一定程度上解释为什么肌腱/韧带内的细胞密度低。肌腱/韧带组织55-70%的组织成分是细胞外基质(ECM),其中主要成分又是水,这也可以解释为什么肌腱/韧带受到损伤后一般组织愈合的速度比较缓慢[7]。在细胞组成方面,肌腱/韧带主要由下列这几种细胞类型组成,包括纤维细胞、成纤维细胞、血管内皮细胞、神经细胞和各种免疫细胞(肥大细胞、中性粒细胞和巨噬细胞等)[8]。纤维细胞是肌腱/韧带中最常见的细胞类型,约占所有细胞中的90%-95%比例[7]。纤维细胞多来源于成纤维细胞,成纤维细胞一般局部分布于原纤丝间隙内,其具有比纤维细胞更大的分化潜能和更高的细胞增殖速率[2, 9-11]。纤维细胞和成纤维细胞是肌腱/韧带中细胞外基质的主要产生者,它们产生并分泌了了几乎所有的细胞外基质成分。在不考虑水分的情况下,肌腱/韧带中细胞外基质主要由胶原纤维组成,占到组织干重的60%-85%。I 型胶原分子的含量最多(80%-90%),其次为III 型胶原分子(1%-10%)和II 型胶原(2%)。肌腱/韧带细胞外基质中还含有少量的弹性蛋白、蛋白聚糖、糖胺聚糖(GAGs)和糖蛋白等。这些功能性生物分子可以增强肌腱/韧带的刚度、韧性和粘弹性等生物力学性能。1.2 肌腱/韧带的螺钉重建与潜在风险肌腱和韧带不仅具有相似的组织结构,当发生意外受损与断裂的情况时,临床上针对肌腱/韧带断端所采取的手术修复方式也比较相似。由于肌腱/韧带是承受较大牵拉应力的特殊组织,因此术者为了尽量提高肌腱/韧带断端的术后固定效果,一般多采用螺钉对肌腱/韧带断端加以固定。为了恢复肌腱/韧带与相邻骨块之间的解剖连接,首先可在受损的肌腱/韧带原始附着部位附近钻取一个直径与螺钉直径相当、深度与螺钉长度相当的骨性隧道,然后将游离的肌腱/韧带断端插入骨性隧道,并最后植入选取的金属螺钉将断端肌腱/韧带牢牢固定在骨性隧道内[12-15]。传统的金属螺钉通常采取的是常规实心结构的设计,作为植入于骨组织内的金属物体,不可避免地将会造成应力屏蔽现象,即植入了螺钉后的骨块内部,应力将会集中分布于螺钉区域,而不是均匀地分布在螺钉以及邻近骨组织区域内[16, 17]。这一问题可能会导致实心螺钉附近的正常骨组织迅速退化,长期将导致严重的骨质疏松甚至病理性骨折的发生[18, 19]。此外,当修复重建的肌腱/韧带在运动状态下绷紧时,来自肌腱/韧带的拉应力会通过螺钉外侧壁与固定的肌腱/韧带末端之间的摩擦力持续牵拉植入的螺钉钉体,这将不可避免地使螺钉产生松动,在最严重的情况下会导致螺钉的脱落与肌腱/韧带重建的失败[20-22]。随着时间的推移,上述问题会不断地增加植入螺钉的不稳定性,这引起了研究人员对肌腱/韧带重建金属螺钉长期固定效果有关的的担忧。1.3 多孔化设计的优势与增材制造技术的发展为了解决上述发生的问题,尽量提高肌腱/韧带重建中植入螺钉的长期固定效果,应将传统的实体螺钉设计摒弃,改为整体多孔的结构设计。当在金属螺钉中引入了多孔化结构的设计后,可以使得螺钉的杨氏模量显著降低,甚至降低至天然蜂窝骨组织的杨氏模量值范围内(1.2-22.3 GPa)[23],进而有效地避免应力屏蔽现象的发生。此外,既往有关研究证明,应用于骨科植入物的多孔结构设计能够有效诱导新生骨组织在植入物中的长入[24-26]。因此,在金属螺钉中采用多孔结构设计,可以增加骨组织在螺钉表面及内部的生长,随着更多的再生骨组织与螺钉相互结合,螺钉的术后固定强度将会随着时间的推移而不断提升。在肌腱/韧带重建这一特殊的临床情景中,植入的螺钉不仅与骨组织相互接触,同时还接触并固定着肌腱/韧带的断端,因此当螺钉的内部引入了适当的多孔结构后,也可能获得额外的肌腱/韧带组织浸润生长能力。当再生的肌腱/韧带组织也能逐步长入到多孔螺钉中,重建的肌腱/韧带断端的机械强度和固定效果也能得到显著的提升,重建固定的肌腱/韧带断端发生意外脱落的可能性也会逐渐降低。因此,为了提高肌腱/韧带重建螺钉的长期固定效果,在实心螺钉内引入适当的多孔化设计是很有必要的。随着增材制造技术的发展,骨科植入物的生物功能优化成为了时下的研究热点,而其中在植入物内引入有利于成骨再生的特定拓扑结构是重要的研究方向之一。一些相关的体外实验发现,在骨科植入物中引入不同的拓扑结构可以为接触着植入物的动物细胞提供一个独特的细胞外微环境,从而直接地影响着细胞的代谢生长行为,包括细胞粘附、迁移、增殖和分化等[27-30]。此外,一些体内实验也证明,骨科植入物内所引入的额外的拓扑结构设计会影响着“植入物-动物组织”界面上组织的再生速率[31-33]。优化的拓扑结构设计可以用来调节多孔植入物的组织长入能力,具体选取的结构设计类型需要与植入物所植入组织的具体类型相互匹配。为了提高肌腱/韧带重建螺钉的整体固定效果,此时需要选取适合于骨组织和肌腱/韧带组织生长的拓扑结构类型,从而促进骨组织和肌腱/韧带组织组织在重建部位的再生。本研究选取了四种经典的增材制造多孔结构设计:Fischer-Koch S、Octet、Diamond 和Double Gyroid 结构,它们被广泛应用于骨科植入物,其中也包括金属螺钉这一常见的骨科植入物[34-42]。Fischer-Koch 、Diamond 和Double Gyroid 结构是三周期最小曲面(Triple Periodic Minimal Surface, TPMS)拓扑类别下的三种典型结构[38, 42],Octet 结构则是原型拓扑类别下的一种经典结构[40]。这四种结构(TPMS 和原型拓扑)属于超材料范畴,其生物力学性能是由其自身的空间拓扑结构所决定的,而非由制造的具体组分材料(金属、高分子聚合物等)所决定的[39, 43-45]。这四种结构是具有高度骨组织仿生度的理想设计,尤其是与天然骨小梁结构相比,具有理想的骨小梁蜂窝结构特征[39, 46-48]。此外,这四种结构都是基于参数化设计的,这表明可以研究者通过调整相关几何参数,从而精准调节这些结构下的骨科植入物的孔隙率数值。因此,这些结构下的骨科植入物的力学性便能可以很容易地调节到所需的天然骨组织范围内。基于以上优势,这四种增材制造拓扑结构设计均适用于肌腱/韧带重建金属螺钉的拓扑优化情景。为了检验这四种结构的实际生物学效应,筛选出最合适于骨组织和肌腱/韧带组织再生的特殊结构,本研究设计并制造了这四种结构下的不同生物支架,并针对这四种结构下的生物支架开展了一系列体外和体内实验,借此探究这些拓扑结构设计在骨与肌腱/韧带再生方面的潜在特征。 
2.1 生物实验支架模型的设计与模拟分析Fischer-Koch S、Octet、Diamond 与Double Gyroid 四种增材制造拓扑微孔结构的物体(如骨科假体或生物支架等)都是基于它们的代表性体积单元构成的,如图2.1A 所示,四种不同的代表性体积单元的空间结构由结构数学函数的几何参数或原型拓扑的几何参数严格定义(见表2.1)。Fischer-Koch S、Diamond 和Double Gyroid 结构属于TPMS 类别,其代表性体积单元结构受所表中不同形式的隐式函数的限制;Octet 结构属于原型范畴,其代表性体积单元结构受到固定空间八面体结构的限制。不同的代表性体积单元代表了不同增材制造拓扑结构所具有的典型特征,通过其自身在空间中进行多次的平移对称复制,大量堆叠,形成相应代表性体积单元的批量阵列,批量列阵再根据实际物体形状进行切割或融合加工,于是生成了不同增材制造拓扑结构下的多孔物体。本实验基于上述设计流程,应用Mathematica(Version 12.0)数字建模软件,制造出了Fischer-Koch S、Octet、Diamond 与Double Gyroid 四种拓扑微孔结构的细胞实验支架和动物实验螺钉支架的简单模型,如图2.1B-2.1C 所示。 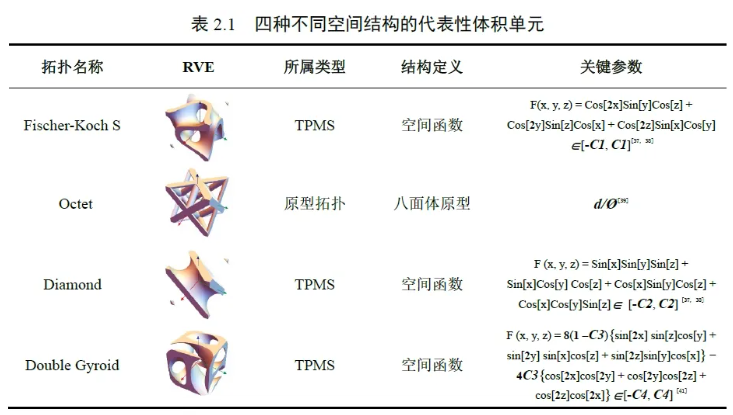
在 Mathematica 软件中,四种不同拓扑结构的代表性体积单元3D模型被生成制造,体积单元的尺寸统一设置为1×1×1mm 值下的立方体,用于接下来体外与体内生物实验支架的设计制造环节。既往文献发现,为了尽可能地提高骨科多孔支架的骨仿生度,需要尽量在支架内部模拟人体蜂窝骨组织的结构特征,而衡量蜂窝骨组织结构的关键数据一般包括骨的孔隙率与骨内部的平均孔径大小,人体蜂窝骨的孔隙率一般在70%左右,孔径大小一般在550 μm 左右,因此我们计划将四种拓扑结构的多孔支架的孔隙率与平均孔径统一为上述值[49]。通过控制表一中的四个关键空间参数值,即可以实现对应结构多孔支架孔隙率与平均孔径的精确调节,本实验通过计算,最终得到当C1、d/Ø、C2、C3、C4 分别设置为0.305、0.269、0.365、1.000、2.104 时,可将四种类型多孔支架的孔隙率与平均孔径统一为70%与550 μm。基于上述四种不同拓扑结构的代表性体积单元及相应的批量阵列,我们设计出直径10 mm、高度2 mm 的片状体外细胞实验支架模型与直径5 mm、高度8 mm 的柱状体内动物实验支架模型(图2.1B-2.1C)。上述支架模型均以立体光刻文件(Stereolithography,STL)的格式输出,用于后续的3D 打印处理。在正式 3D 打印前,有必要对上述四种多孔支架的机械强度做初步的模拟分析,为此,我们导出了四种代表性体积单元的2×2×2 批量阵列,作为四种拓扑结构的多孔支架的简化模型(图3.1B)。将上述四种简化模型输出的STL 导入Comsol (Version 5.3)有限元分析软件,进行初步的应力模拟分析。在传统的骨科金属植入物中,钛合金(Ti6Al4V)具有优良的机械强度和良好的生物相容性,因此我们选其作为支架3D 打印与应力模拟分析的主体材料[50-52]。在Comsol 软件的体块设置模块中,将导入的多孔支架的简化模型的材料属性勾选为“Ti6Al4V”,网格形状勾选为“四面体网格”,网格质量勾选为“次级细分”(图3.1C)。在Comsol 软件的应力设置模块中,将边界载荷设置在支架的上表面,固定约束设置在下表面,垂直应力设置为5×107 MPa 大小,从而模拟计算出该应力条件下不同支架内部的von Mises 应力分布情况。2.2 体内外生物支架打印本实验采用 EBM 3D 打印机(Arcam)对设计好的体内外支架进行3D 打印与制造。打印前,支架模型的STL 文件依次输入打印机的操作系统,并选择粒径范围在45-100 μm 的Ti6Al4V 球形粉末装载入打印机内,作为打印的初始材料。待机器的打印程序完成、打印仓冷却后,取出打印好的支架,在高速风仓内简单吹除剩余粉末,并将支架浸于水中进行超声振荡清洗一整夜,彻底清除多孔支架内的残留粉末。上述体内外支架的3D 打印制造与处理过程在吉林省长春市吉林大学第二医院骨科研究所完成。
2.3 支架表征及结构检测
将打印初始材料的Ti6Al4V 球形粉末样品和四种类型的体外多孔支架样品装入扫描电子显微镜(SEM,Regulus8100),逐一拍摄不同样品在50、500、1000 倍放大下的表面形貌电子照片。再次准备相同的Ti6Al4V 粉末样品与体外多孔支架样品,将样品装入能量色散光谱仪(EDS,IXRF3310),依次分析打印前后不同样品内部的元素组成。
2.4 机械强度测试
为了探究经 EBM 3D 打印得到的四种不同拓扑结构多孔支架之间的实际机械性能差异,我们使用了电子万能试验机(ZWICK-Z250)评估了打印后四种体内螺钉支架样品与同尺寸下实心圆柱螺钉的压缩模量和名义屈服强度。测试中设置电子万能试验机的十字头的压缩速度为1 mm/min,在整个压缩过程中实时输出不同样品的应力-应变曲线。应力-应变曲线开始的直线段斜率即定义为不同样品的压缩模量,同时基于该曲线,计算得到四种支架与实心样品的名义屈服强度(发生0.2%塑性形变时对应的应力),分别反映不同样品之间的实际机械强度水平。
2.5 体外细胞实验
为了在体外细胞层面探究Fischer-Koch S、Octet、Diamond 与Double Gyroid 四种增材制造拓扑微孔结构对成骨与成肌腱/韧带的影响,我们分别选取了小鼠成骨前体细胞MC3T3-E1(iCell M075TM)与小鼠胚胎成纤维细胞C3H10T1/2(iCell M031TM),用在接下来的一系列细胞实验之中,通过这些细胞实验来充分探究上述四种拓扑微孔结构对成骨细胞增殖分化以及对成纤维细胞增殖分化的潜在影响。
2.5.1 细胞培养和接种
将购买的原代 MC3T3-E1 细胞浸于37 °C 水浴箱中完全复苏,接种在培养皿(100 × 20 mm 规格)中,用含有10%胎牛血清、100 U/mL青霉素和100 mg/mL 硫酸链霉素的高糖杜尔贝科氏改良Eagle 培养基(DMEM,Gibco)10 mL 进行细胞培养,将细胞传代至第3 代。同理,将购买的原代C3H10T1/2 细胞充分复苏,用含有10%胎牛血清、100 U/mL 青霉素和100 mg/mL 硫酸链霉素的低糖阿尔法低必需培养基(α-MEM,Gibco)进行细胞培养,并将细胞传代至第3 代。当贴壁增殖的第三代MC3T3-E1 或C3H10T1/2 细胞覆盖约90%的培养皿时,用2 mL 0.25%浓度的胰蛋白酶消化2 min 将细胞脱壁, 脱壁后的细胞液在1200 rpm 下离心5 min,再用5 mL 不同细胞相应的培养基重悬。重悬的MC3T3-E1 或C3H10T1/2 细胞悬液中含有的细胞数量用细胞计数板简单计算,并用相应的培养基统一稀释至2 × 105/mL 的数量浓度值,从而制备得到两种不同细胞的标准细胞悬液,用以后续体外细胞支架的细胞接种步骤。经过严格高压蒸汽灭菌30 min,四种不同结构的多孔体外细胞支架被放置于48 孔板中,在每个孔中加入不同细胞实验实际所需细胞数相对应体积的标准细胞悬液,在细胞孵育培养箱(37℃,5% CO2,饱和湿度环境)中孵育2 h,使得细胞初步沉降并贴附到支架上,通过上述步骤,即可完成体外细胞实验前期细胞培养与接种的准备工作。
2.5.2 细胞增殖活性实验
为了检测 MC3T3-E1 和C3H10T1/2 细胞在四种不同结构的多孔体外细胞支架中的增殖活性差异,我们依次开展了活/死细胞(BestBio,BB-4126)染色实验、细胞计数CCK-8(AbMole, M4839)染色实验和FITC-phalloidin/DAPI (Yeasen, 40735ES75)染色实验。在活/死细胞染色实验中,首先将含有1 × 105 个MC3T3-E1 或C3H10T1/2 细胞的标准细胞悬液接种在四种不同结构的体外细胞支架上,再用相同的培养基继续进行细胞培养,使接种在支架上的细胞将在支架表面持续扩增。实验共设置三个实验组,使MC3T3-E1 或C3H10T1/2 细胞在不同的支架上分别生长1、3、5 天,记为Day1、Day3、Day5 实验组。不同组的实验样品(长有细胞的支架)用400 μL 溶液A (Calcein-AM,1:1000)浸泡处理30 min,将样品表面的所有活细胞充分染色,再用400 μL 溶液B (PI,1:2000)浸泡处理2 min,将样品表面的所有死细胞充分染色。A、B 溶液均用汉克斯平衡盐溶液(HBSS)稀释,染色过程中严格避光。染色完毕后用适量的磷酸盐缓冲液(PBS)轻轻洗涤样品2 次,将样品转移至倒置显微镜(Olympus)下进行观察。为了进一步检测细胞在四种不同结构的体外细胞支架上的具体增殖速率,我们采取了细胞计数CCK-8 染色实验的方法。在CCK-8染色实验中,将1 × 105 个MC3T3-E1 或C3H10T1/2 细胞接种在四种体外细胞支架上,并设置Day1、Day3、Day5 三个实验组。培养了相应天数的实验样品分别浸于CCK-8 : HBSS 为1:10的混合溶液550μL 中,在细胞孵箱中避光反应2 h。反应后溶液的吸光度值(OD 值)通过分光光度仪精准测量,分光仪的激发波长值设置为550 nm,最终通过测得样品的OD 值的大小,反映出不同时间点下样品含有的细胞数目的多少,并对OD 值进行统一的标准化计算,得到两种细胞在四种多孔支架上的增殖速率的高低差异。
通过上述两项实验,MC3T3-E1 和C3H10T1/2 细胞在四种不同结构的体外细胞支架表面存活与增殖情况得到了很好的验证,但细胞在支架表面生长的形态状况尚不明确,因此我们补充开展了FITCphalloidin/DAPI 染色实验,希望明确多孔支架的四种结构对细胞形态可能造成的影响。同样将1 × 105 个MC3T3-E1 或C3H10T1/2 细胞接种在四种体外细胞支架上,统一培养3 天,在第3 天收集实验样品,用300 μL 的4%多聚甲醛处理样品10 min,将细胞杀死并固定细胞形态。固定后的样品转移入300 μL 的Triton X-100 溶液中,反应5 min,以提高固定细胞的细胞膜渗透性。二次处理后的样品最终用FITCphalloidin的PBS 稀释液(1:200)对细胞骨架进行染色30 min,接着用DAPI 的PBS 稀释液(1:500)对细胞核进行染色5 min。染色过程中全程避光,以避免荧光染剂受光照而发生淬灭,影响样品最终的显色效果。染色完成的样品转移至倒置显微镜(Olympus) 下观察和成像。
2.5.3 茜素红染色实验
茜素红染色剂(Alizarin Red S)是骨科实验中的一种常用的试剂,能特异性地结合钙离子配体,产生深红色的离子化合物,因此多用于成骨细胞胞外基质中的钙结节沉积显色。在茜素红染色实验中,首先将1 mL 的MC3T3-E1 标准细胞悬液(2 × 105 细胞)接种在四种不同结构的体外细胞支架上,静置2h,待细胞沉降并粘附于支架表面,吸除普通的细胞培养基,改用成骨诱导培养基进行细胞培养。成骨诱导培养基需提前配制,其成分是在细胞培养基DMEM 的基础上,加入了50 mg/L 的维生素C、10 mmol/L 的β-甘油磷酸钠以及10-8 mol/L的地塞米松。实验共设置三个实验组,对生长在不同支架上的MC3T3-E1 细胞进行成骨诱导培养4、7、14 天,分别记为Day4、Day7、Day14实验组。将不同组别的实验样品用300 μL 的4%多聚甲醛溶液固定细胞10 min,然后用500 μL 茜素红S 溶液(Beyotime, C0138)染色30min,使支架表面的钙结节充分显色。染色完成后,样品用蒸馏水轻轻洗涤两次,在空气中干燥10 min,转移至普通光学显微镜下观察与摄像。为了进一步测量不同支架表面胞外基质钙结节沉积的实际含量,将染色后的样品依次浸泡在400 μL 10%质量浓度的氯化十六烷基吡啶溶液(CPC)中,在37℃下反应30 min,使得钙结节沉积充分溶解在CPC 溶液中。CPC 溶液后续在分光光度仪中以562 nm 的激发波长检测溶液的OD 值,用以代表MC3T3-E1 细胞在不同时间点所产生的细胞外钙结节的沉积量。
2.5.4 碱性磷酸酶检测
碱性磷酸酶(ALP)是成骨细胞内反映成骨代谢强弱的一个关键分子指标,其在细胞内的活性强弱能直接体现细胞的成骨状态与成骨功能的高低,因此本实验通过检测MC3T3-E1 细胞在四种不同结构的细胞支架内生长时细胞内部ALP活性的实际差异,侧面证明不同的多孔结构对成骨代谢带来的潜在影响。将1 mL MC3T3-E1 标准细胞悬液(含2×105 细胞)接种在四种不同结构的体外细胞支架上,静置2h 待细胞在支架上初步粘附,更换成骨诱导培养基继续培养7 天和14 天,分别记为Day7 与Day14 实验组。在相应的时间点,收集得到的各组样品,用500μL 的RIPA 裂解缓冲液(Beyotime, P0013K)将支架表面细胞彻底裂解,提取出四种支架上生长了7天或14天的MC3T3-E1细胞的所有蛋白。采用ALP检测试剂盒(Beyotime,P0321M),定量分析各样品裂解液中的总ALP活性,将蛋白液样品与显色底物按1:1比例混合摇匀,在37℃下孵育30 min,再加入混合液等体积的反应终止液,于分光光度仪中以405nm 的激发波长检测溶液的OD值,参照说明书标准曲线计算得到样品的ALP活性值,单位记为U。为了消除不同样品之间因蛋白质总含量不同造成的潜在干扰,因此再次重复上述细胞接种与和培养过程,取200 μL RIPA 裂解液提取生长在四种支架上的MC3T3-E1 细胞的所有蛋白,采用BCA蛋白检测试剂盒(Beyotime, P0012)分析总蛋白含量,将A 液与B 液提前以50:1 比例混合配制工作液,工作液再以10 倍于蛋白液的比例与蛋白液混合均匀,室温下孵育2 h,在分光光度仪中以562 nm 的激发波长检测溶液的OD 值,参照说明书标准曲线计算得到样品的蛋白含量,单位记为mg。用总ALP 活性值除以总蛋白含量值,最终计算得到不同样品的标准化ALP 活性,单位记为U/mg。
2.5.5 逆转录聚合酶链式反应实验
在本实验中,为了在基因表达的层面上反映MC3T3-E1 和C3H10T1/2 细胞在不同体外支架上的成骨与成肌腱/韧带分化水平,开展了一系列针对成骨与成肌腱/韧带分化基因表达水平检测的逆转录聚合酶链式反应(RT-PCR)实验。将含2 × 105个细胞的1 mL MC3T3-E1 或C3H10T1/2 标准细胞悬液接种在四种不同拓扑结构的体外细胞支架上,静置2h 待细胞初步沉淀粘附后,更换成骨诱导培养基或成肌腱/韧带培养基继续培养7 天和14 天,分别记为Day7 与Day14 实验组。成骨培养基的成分同2.5.4 节中所述,成肌腱/韧带培养基的成分则是在细胞培养基α-MEM 的基础上,加入了1 mmol/L 的维生素C、0.04 mmol/L 的 L-脯氨酸以及10 μg/L 的成纤维细胞生长因子-2。实验选用RNA 提取试剂盒(Solarbio, R1200)提取出了不同样本的总RNA,使用每个样本中1 μg 的总RNA,用于后续RNA 对应的cDNA的合成。实验将提取得到的1 μg 的总RNA 用SureScript 试剂盒(GeneCopoeia, QP057)合成对应的一链cDNA,再将合成的一链cDNA 用BlazeTaq SYBR GREE 试剂盒(GeneCopoeia, QP033)进行聚合酶链式反应扩增,最后在BIO-RAD 荧光定量PCR 仪中分析出目的基因的熔融曲线及实际含量。在C3H10T1/2 细胞核内的基因谱中,我们选取了表达量稳定的Rplp0 作为该细胞的内参基因,旨在衡量C3H10T1/2 细胞中成肌腱/韧带关键基因Col1a1、SCX、DCN 的表达水平。在MC3T3-E1 细胞核内的基因谱中,我们则选取了表达量同样相对稳定的β-actin 作为该细胞的内参基因,用以衡量MC3T3-E1细胞中成骨关键基因ALP、OCN、OPN、Runx-2 的表达水平。实验中用到的所有内参基因及目的基因的相关引物序列见表2.2,不同基因的最终表达水平结果采用delta-delta Ct 法(2-ΔΔCt)进行计算分析。

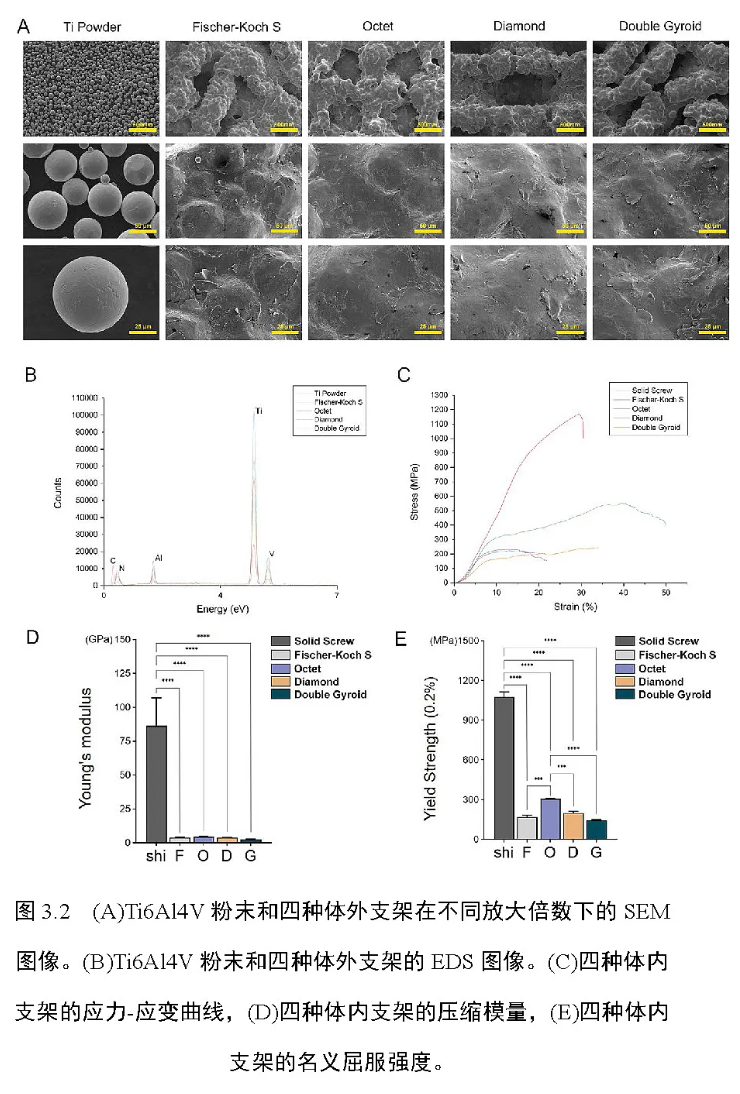
2.6 体内动物实验除了上述的一系列体外细胞实验,实验计划在此基础上额外开展针对新西兰白兔的体内动物实验,以进一步分析四种拓扑微孔结构支架体内成骨能力的具体差异。体内实验选取健康的成年雄性新西兰白兔作为实验对象,每个实验组下划分三只以得到三个重复样品进行后续实验分析,白兔的体重统一严格控制在3.0 ~ 3.5 kg 的范围内。实验过程中对所有白兔施以完全相同的手术操作,尽量避免因手术流程环节的差异对实验结果造成潜在干扰。实验采用10%盐酸氯丙嗪,以0.2 mL/kg 的剂量对白兔肌肉注射麻醉,10 min 待白兔充分麻醉后,在兔下肢膝关节内侧股骨端切一10 cm 切口,由浅入深逐层暴露兔的股骨内侧髁,做好标记,并在冠状面上统一水平钻取一半径为5.5 mm、深度为10 mm 的骨缺损隧道。在不同实验组的白兔骨缺损隧道中相应植入四种不同的3D 打印体内动物支架,固定牢固后,将切开的软组织用可吸收外科缝线逐层紧密缝合,待接下来4 ~ 8 周内,骨缺损逐渐愈合,骨组织在支架内持续长入。所有的手术操作均严格遵循临床外科手术的原则,并全称在无菌条件下进行,术后前三日内每日以105 U 的剂量对白兔施以青霉素肌肉注射,通过上述操作,防止白兔因手术创伤造成的感染与损耗,有利于骨缺损的愈合与骨组织的再生恢复。手术4 周或8 周后,在相应时间节点对实验动物进行二氧化碳安乐死处理,收集得到先前植入了体内支架的股骨远端骨块标本,用4%多聚甲醛溶液充分浸泡固定,用于后续的样品分析。实验中涉及的所有程序与操作均严格遵循实验伦理有关的法律、法规以及动物伦理学的学科规定,实验经由吉林大学基础医学实验教学中心的批准,批准文号为2023430。2.6.1 micro-CT 分析将先前收集得到的植有不同组别体内支架的股骨远端骨块样品从多聚甲醛中取出,置于阴凉空气中干燥10 min,转移到micro-CT仪(Skyscan1076)进行micro-CT 扫描。扫描仪机器参数设置为电压70 kV、电流141 μA、精确度12.6 μm。通过仪器扫描,生成了不同样品的断层扫描图片,将图片文件包导入CTVol (Version 2.0)软件中,实现不同骨块样品的三维模型重建。在样品的三维模型中,可以清晰显示植入股骨远端内部的金属多孔支架,并显示出支架周围新生骨组织的分布情况。基于三维重建的模型数据,软件能够定量计算出支架周围新生骨组织的成骨指标,包括BV/TV(骨体积分数,骨体积/骨缺损总体积)、Tb. Th(骨小梁厚度)、Tb. Sp(骨小梁分离度),Tb.N(骨小梁数量)和BS/TV(骨表面积密度,骨表面积/骨缺损总体积)。通过比较不同样品的上述新生骨组织成骨指标,综合反映出不同样本的新生骨质量,从而体现不同的拓扑微孔结构支架对体内成骨的具体影响。2.6.2 组织切片分析重复 2.6 节中相同的实验操作,得到4 周、8 周两个时间点下分别植有不同类型体内支架的股骨远端骨块样品,将浸泡固定于多聚甲醛中的股骨远端标本再次取出,浸于100%的丙酮液中进行脱水处理,随后将样品包埋在聚甲基丙烯酸甲酯中。包埋样品转移至硬组织切片机(EXAKT300CP)中,将包埋组织切成300μm厚的组织切片,切割平面选取在股骨远端冠状面,切割面通过体内支架的纵轴,以充分显示骨缺损内植入的支架和周围骨组织再生情况。将组织切片依次行苏木精-伊红染色与甲苯胺蓝染色,切片充分染色后转移至共聚焦显微镜(LEICA TCS SPE)下观察并成像,获取不同切片的低倍视角(5×)、中倍视角(12.5×)、高倍视角(25×)图像,在不同的放大视野下仔细观察骨缺损愈合情况及体内支架周围骨组织的再生情况。2.7 数据统计分析本实验中所有实验数据均采用 GraphPad Prism (Version 9.2)统计软件进行数据分析,所有定量数据均以平均数±标准差(SD)的形式表示并绘制在相应统计图表中。每个实验组下分别设置有3 个重复样品,不同实验组结果数值采用独立样本t 检验和双因素方差分析进行计算与分析,结果P < 0.05 则提示实验结果的差异具有统计学的意义。3.1 应力分布模拟与支架打印图 3.1A~3.1B 显示了在Comsol 软件中不同拓扑微孔结构的RVE模型以及对应的2 × 2 × 2 简化支架模型。在进行有限元计算前,不同简化支架模型的具体网格划分如图3.1C 所示。通过Comsol 软件的有限元计算分析,四种简化支架模型在5 × 107 MPa 垂直载荷下的von Mises 应力分布如图3.1D 所示。图中结果表明,四种结构的多孔支架均能够承受较大的机械应力,机械应力在支架内部都能较为均匀地分布,因此四种拓扑结构被证明均具有优良的机械强度性能。图3.1E~3.1F 为通过EBM 3D 打印技术打印得到的四种拓扑微孔结构体外细胞支架和体内动物支架,打印结构表明EBM 3D 技术具有较高的打印精度,实际微孔拓扑结构的打印效果良好,所采用的打印机的打印过程稳定,并没有出现支架塌陷以及孔隙开裂等异常的打印状况。3.2 材料结构表征与机械强度测试通过一系列的材料结构表征检测,图 3.2A-3.2B 显示了Ti6Al4V球形粉末样品和3D 打印的四种不同拓扑微孔结构体外支架的实际SEM 和EDS 图像。利用EBM 3D 打印技术,成功制造出了所需的四种目标支架,相应的四种微拓扑结构的典型特征和细节通过该打印技术得到充分体现,且打印前后材料的主要构成元素基本不变,证实了EBM 打印技术的准确性和稳定性很高,打印质量优良。四种支架的表面粗糙度相同,这保证了四种支架在生物功能上差异主要是由于其自身不同的微拓扑结构造成,而不是由于其表面粗糙度的不同而造成(图3.2A)。值得注意的是,通过EBM 3D 打印技术,原材料Ti6Al4V球形粉末中含有的少量碳杂质被消除,且不可避免地引入了微量的氮元素,这可能是由于EBM 打印过程中产生的高温高能电子束造成的(图3.2B)。一系列的机械强度测试结果显示,与相同尺寸下的普通实体钛合金螺钉相比,四种多孔拓扑结构的引入均显著降低了支架整体的压缩弹性模量和名义屈服强度。在此基础上,这些多孔拓扑支架仍保留着足够的机械强度,数据结果显示,四种微孔结构的支架与天然骨组织的机械强度相当,并没有因为自身的多孔化而损失骨植入物所需的基本机械性能(图3.2C-3.2E)。3.3 体外细胞增殖实验活/死细胞染色结果显示(图3.3A-3.3B),成骨细胞MC3T3-E1和胚胎成纤维细胞C3H10T1/2 均能在四种支架表面附着并持续增殖,该结果表明四种支架在体外具有实际的骨与肌腱/韧带细胞亲和能力。在接种后的5天内,MC3T3-E1 和C3H10T1/2 细胞持续增殖,两种细胞在第3 ~ 5 天的增殖速度较第1 ~ 3 天明显加快,且在接种后的5天内基本不发生细胞的死亡,在显微镜视野下相较于活细胞基本上观察不到死细胞,这进一步印证了四种支架均具有理想的生物相容性。为了进一步检测出 MC3T3-E1 和C3H10T1/2 细胞在这四种不同拓扑微孔结构支架中的各自的细胞增殖速率,我们在活/死细胞染色实验基础上继续进行了CCK-8 染色实验(图3.3C-3.3D 所示)。在第3天时,四个实验组支架内的MC3T3-E1 细胞增殖速率并没有明显统计学差异,四个组的增殖速率结果在此时均处于低值范围内。培养至第5天时,MC3T3-E1 细胞的增殖速率显著增加,其中以Fischer-KochS 组、Octet 组和Diamond 组增长最为明显。与Double Gyroid 组相比,Fischer-Koch S 组、Octet 组和Diamond 组的MC3T3-E1 细胞增殖速率达到了更高的数值水平(图3.3C)。有所不同的是,对于接种在四种多孔支架上的C3H10T1/2 细胞,在第3 天和第5 天的增殖速率值均显示具有明显的统计学差异。在这两个时间点,四个实验组支架内的C3H10T1/2 细胞显示出比较相似的增殖速率差异,Fischer-Koch S 组、Octet 组和Double Gyroid 组的C3H10T1/2 增殖速率大大高于Diamond 组,其中又以Fischer-Koch S 组和Double Gyroid 组更为显著(图3.3D)。 
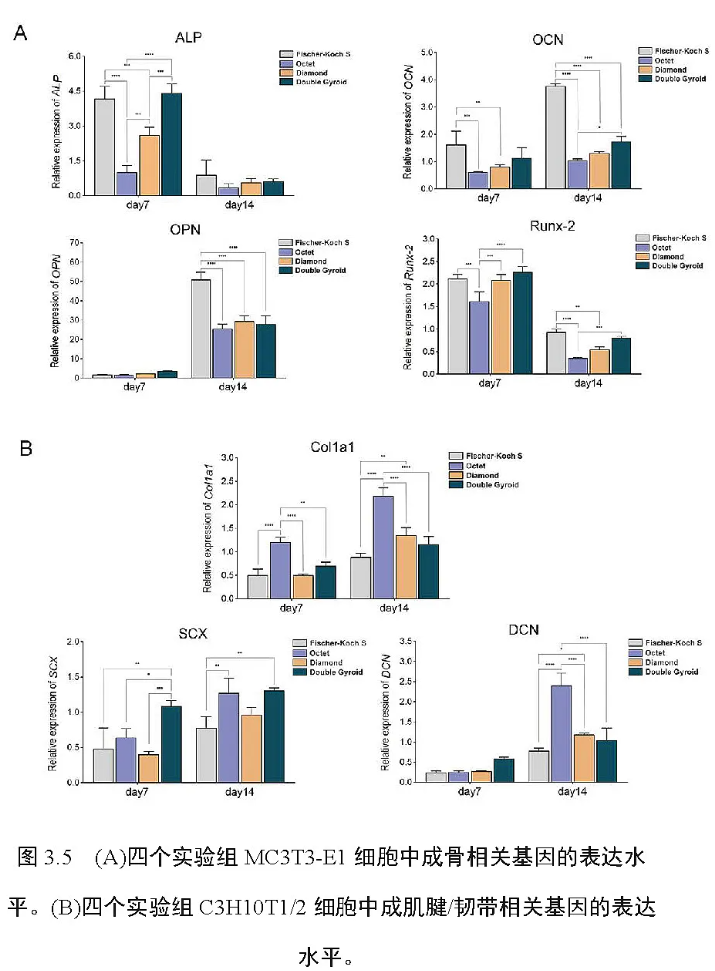
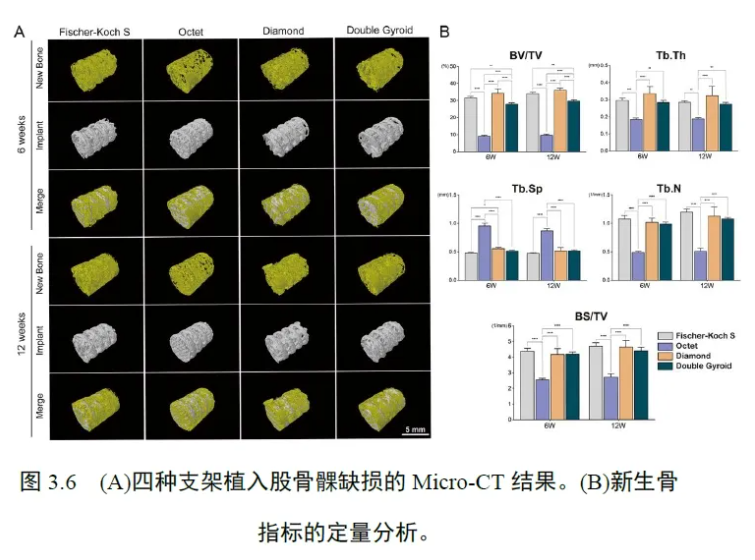
通过上述活/死细胞染色实验与CCK-8 染色实验,成功揭示出了四种不同的拓扑微孔结构设计对成骨、成肌腱/韧带细胞增殖率的影响。为了进一步揭示四种不同的拓扑微孔结构设计对成骨、成肌腱/韧带细胞生长形态造成的潜在影响, 我们继续进行了FITCphalloidin/DAPI 染色实验。通过该荧光染色实验,生长在四种不同支架上的MC3T3-E1 和C3H10T1/2 细胞的细胞骨架与细胞核得到了清晰的显影(图3.3E-3.3F)。实验结果显示,当MC3T3-E1 细胞在Fischer-Koch S 支架和Double Gyroid 支架中生长时,细胞之间相互接触和连接的细胞骨架更为丰富,因此Fischer-Koch S 和Double Gyroid 这两种多孔结构在促进MC3T3-E1 细胞的迁移与延展上显示出独特的生物功效。此外,当C3H10T1/2 细胞在Fischer-Koch S、Octet 和Double Gyroid 支架中生长时,细胞显示出更大的体积,细胞的形态更为伸展;与之相比的是,当C3H10T1/2 细胞在Diamond 支架中生长时,细胞表现出相对明显的细胞皱缩和相对较差的细胞延展现象。因此,为了进一步提高C3H10T1/2 细胞在多孔支架内生长时的骨架延展和细胞迁移能力,最好采用Fischer-Koch S, Octet 或Double Gyroid 结构,而并不推荐采用性能较弱的Diamond 结构。3.4 体外茜素红染色实验本实验通过茜素红溶液的体外染色,分析了MC3T3-E1 细胞在四种不同拓扑微孔结构支架中所产生的细胞胞外基质钙结节沉积含量,用以衡量MC3T3-E1 成骨细胞在不同支架内的成骨活性的高低差异(图3.4A-3.4B)。最终各实验组CPC 溶液的OD 值显示,在成骨分化培养的第1 周内,四种支架内的产生的胞外钙沉积含量均较低,无明显统计学上的差异;在成骨分化培养的第1 ~ 2 周,四种支架内胞外钙沉积含量显著增加。与Octet 组相比,Fischer-Koch S 组、Diamond组和Double Gyroid 组均产生了更多的细胞外钙沉积,因此这三种结构下的多孔支架被认为更有利于成骨细胞胞外钙沉积的生成与分泌。3.5 体外碱性磷酸酶检测为了检测 MC3T3-E1 细胞在四种不同拓扑微孔结构支架中的成骨代谢差异,用以反映不同支架拓扑结构对细胞成骨状态的潜在影响,本实验分别检测了四个实验组在不同时间节点下的ALP 活性。实验结果显示,在第7 天时,Fischer-Koch S 组、Diamond 组和Double Gyroid 组MC3T3-E1 细胞的ALP 活性值相对较高,此时四个实验组中Fischer-Koch S 组的ALP 活性值最高,Octet 组的ALP 活性值最低。在第14 天时,Fischer-Koch S 组和Diamond 组ALP 活性值较高,这时Diamond 组ALP 活性值最高,Octet 组ALP 活性值最低。从第7天到第14天,四个实验组的ALP 活性值整体均表现出轻微的下降趋势,然而四组中Fischer-Koch S 组和Diamond 组ALP 活性值始终保持在较高的水平,而Octet 组ALP 活性值始终保持在四组支架中的最低水平(图3.4C)。3.6 体外 RT-PCR 实验通过在 2.5.5 节中介绍的RT-PCR 检测步骤,本实验最终在细胞基因表达的水平上反映了MC3T3-E1 和C3H10T1/2 细胞在四种不同拓扑微孔结构支架中的成骨与成肌腱/韧带分化水平。针对MC3T3-E1细胞,实验选取了四个经典的成骨分化相关基因:ALP、OCN、OPN、Runx-2,并检测了这几种基因在MC3T3-E1 细胞内部不同时间点下的表达水平(图3.5A)。结果显示,ALP 基因和Runx-2 基因在FischerKoch S 组、Diamond 组和Double Gyroid 组细胞中的表达水平相对较高。同时,在四个实验组别中,OCN 基因和OPN 基因在Fischer-Koch S 组细胞中的表达水平较高。从第7 天到第14 天,OCN 基因和OPN基因的表达水平总体呈现上升的趋势,而ALP 基因和Runx-2 基因的表达水平总体呈现下降的趋势。值得注意的是,四个成骨相关目标基因的表达水平在Octet 组细胞中均表现为最低,提示Octet 结构对细胞成骨分化的促进效果可能最为微弱。图 3.5B 描述了生长在四种不同微孔结构支架上的C3H10T1/2 细胞内肌腱/韧带分化相关基因在不同时间点下的表达水平,针对C3H10T1/2 细胞,实验选取了三个经典的成肌腱/韧带分化相关基因:Col1a1、SCX、DCN。实验结果显示,Col1a1 基因和DCN 基因在Octet组细胞中的表达水平较高,SCX 基因在Octet 组和Double Gyroid 组细胞中的表达水平较高。从第7 天到第14 天,Col1a1、SCX 和DCN基因的总体表达水平呈现上升的趋势。在所有的实验组中,三个成肌腱/韧带分化相关基因的表达水平在Fischer-Koch S 组细胞中均处于最低值,提示Fischer-Koch S 结构在提升细胞内肌腱/韧带分化水平方面的生物功能较为不足。3.7 体内 micro-CT 分析利用 micro-CT 技术,本实验通过对分别植有四种不同微孔结构体内支架的股骨远端骨块样品进行全面扫描,最终完整生成了这四种支架在股骨内侧髁骨缺损内的三维重建图像,图像详细显示了不同骨块样品相应骨缺损内新生骨组织的分布情况(图3.6A)。新生骨组织为图中显示的黄色区域,金属支架为图中显示的灰色区域,结果表明在多孔支架植入之后,骨缺损内新生骨组织在多孔支架的周围不断地修复再生,部分新生骨组织显示已经成功地生长并渗入了支架的孔隙中。在此基础上,实验逐一分析计算了四个实验组之间新生骨组织成骨指标:BV/TV、Tb. Th、Tb. Sp、Tb. N 与BS/TV(图3.6B)。BV/TV和Tb. Th 指标分别用以测量新生骨组织骨小梁的总体积和平均厚度,结果显示,这两个指标在Fischer-Koch S 组、Diamond 组和Double Gyroid 组中的数值相对较高,而在这三个实验组中,上述两项指标在Fischer-Koch S 组和Diamond 组中的提升尤为显著,这说明这两种多孔结构较其他结构在体内能诱导产生更多的骨组织的再生。Tb. Sp 成骨指标代表着新骨小梁间髓腔间隙的平均宽度值,该指标在Fischer-Koch S 组、Diamond 组和Double Gyroid 组中均较低,其中Fischer-Koch S 组数值最低。Tb. N 成骨指标表示平均每毫米内新生骨组织的骨小梁数量,而BS/TV 成骨指标表示新生骨小梁的总表面积。Tb. N 和BS/TV 值在Fischer-Koch S 组、Diamond 组和Double Gyroid 组中相对较高,其中以Fischer-Koch S 组的数值最高。结合上述Tb. Sp、Tb. N 与BS/TV 三个成骨指标结果,实验提示Fischer-Koch S、Diamond 和Double Gyroid 结构均能在骨缺损的体内环境诱导产生更为致密与表面积更大的新生骨组织,其成骨功效比较显著。3.8 体内组织切片分析本实验利用硬组织切片技术,对植入有四种不同微孔结构体内支架的股骨远端骨块样品逐一进行了进行了苏木精-伊红染色与甲苯胺蓝染色,从而在组织学层面对植入了支架的骨缺损内部及支架周围的新生骨组织进行了染色分析。图3.7A 为四个实验组实验样品的苏木精-伊红染色结果,染色切片中红色区域表示为骨缺损内新生的胶原结缔组织,其主要是由新生的骨组织和新生的软骨组织构成。为了进一步探究上述胶原结缔组织的具体组织构成,本实验对骨块的切片样品继续进行了甲苯胺蓝染色(图3.7B),该染色切片中浅蓝色或深蓝色区域代表着新生的骨组织,红紫色区域则代表着新生的软骨组织。根据上述组织切片的染色结果分析证明,不同实验样品骨缺损内新生的胶原结缔组织几乎全部是由新生骨组织组成的,仅仅在Fischer-Koch S 组和Double Gyroid 组样品的染色切片中可见到少量的新生软骨组织成分。在四个实验组中,Fischer-Koch S 组、Diamond 组和Double Gyroid 组的支架周围显示有更多的新生骨组织形成,并且再生的骨组织与这三种支架之间接触结合得相对较为紧密。除此之外,四个实验组的组织切片中均未见到有明显的炎性组织存在,这表明这四种支架均具有良好的生物相容性,在植入动物体内的骨组织环境后内并不会表现出明显的组织异质性,不会激发出组织周围明显的免疫炎症反应。当多孔支架植入了骨缺损8 周后,Fischer-Koch S 组、Diamond 组和Double Gyroid 组支架周围均可见到典型的哈弗氏骨结构,这进一步证明了这三种类型的多孔支架在促进新生骨组织的成熟方面具有一定的优势。 

钛合金(Ti6Al4V)螺钉由于钛金属材料自身具备着优良的机械强度和生物相容性,是常见的骨科金属植入物之一,在临床中可以被用在重建肌腱/韧带的手术之中[50-52]。传统的钛合金螺钉通常采用着简单的实心设计,因此不可避免地会产生应力屏蔽现象和术后松动问题[16, 17]。为了有效改善上述问题,本实验在传统的实心钛合金螺钉内部引入了额外的多孔化拓扑结构,使得螺钉整体的弹性模量大大降低,进而有效地避免了应力屏蔽现象的发生。此外,多孔结构的引入为螺钉提供了更多的内部孔隙空间,使得肌腱/韧带重建部位新生的骨组织和肌腱/韧带组织能够逐渐长入螺钉的孔隙之中并与螺钉之间产生更为紧密的组织整合,进而显著地提高螺钉体内植入术后的长期固定效果。为了筛选出足够理想的多孔拓扑结构,从而尽可能地提高钛合金螺钉的成骨和成肌腱/韧带生物性能,我们初步选择了四种经典的增材制造拓扑微孔结构设计(Fischer-Koch S、Octet、Diamond 和Double Gyroid),并将其引入到实心钛合金支架中,以进行后续的相关体内外生物学研究。本实验利用EBM 3D 打印技术,成功制造出了这四种经拓扑结构优化设计的多孔生物支架,并利用打印所得到的支架,开展了一系列体外和体内实验。通过上述一系列的体内外生物实验的反复验证,本研究充分揭示了钛合金螺钉内部不同的拓扑结构对骨和肌腱/韧带再生可能造成的潜在影响,为钛合金螺钉未来的拓扑优化提供了一些新的方案,以更好地贴合于肌腱/韧带的螺钉重建这一特殊的临床情景。为了比较四种增材制造拓扑微孔结构下的多孔钛合金支架在骨再生能力上的差异,我们详细检测了生长在这些支架中的成骨细胞(MC3T3-E1)的增殖代谢活性和成骨分化活性。活/死细胞染色和CCK-8 染色实验结果表明,成骨细胞在Fischer-Koch S 支架中增殖速率得到显著提升。此外,FITC-phalloidin/DAPI 染色实验结果表明,成骨细胞在Fischer-Koch S 和Double Gyroid 支架中生长时能产生更丰富的细胞骨架,呈现出更为伸展的细胞形态,这表明上述两种结构可以明显改善成骨细胞的迁移和浸润能力。通过这三个细胞增殖活性实验的综合分析,研究证明Fischer-Koch S 结构在提升成骨细胞的增殖能力上效果最为突出。除了细胞增殖活性实验,本研究还开展了茜素红染色实验、ALP 染色实验和RT-PCR 实验,对四多孔种支架中成骨细胞的胞外钙结节沉积、胞内ALP 活性和成骨分化相关基因(ALP、OCN、OPN、Runx-2)表达水平逐一进行了检测,用以揭示四种结构的多孔支架对于成骨细胞成骨分化方面可能产生的影响。Runx-2 基因是成骨分化的一个关键调控因子,它能够上调许多其他下游的成骨分化相关基因,包括ALP、OPN 和OCN 等基因[53, 54]。ALP 是成骨细胞内存在的一种关键的蛋白酶,它能够水解焦磷酸(一种能抑制羟基磷灰石形成的胞内物质),并生成大量的磷酸盐。磷酸盐是生成羟基磷灰石的关键底物,当生成的磷酸盐与钙离子结合,便不断形成新的羟基磷灰石晶体(骨基质的主要成分)[55]。新形成的羟基磷灰石晶体随后会受到OPN 和OCN 共同的调节和重塑,从而促进羟基磷灰石晶体最终的成熟[56-61]。因此,以上这四个成骨基因在细胞的成骨分化过程中起着至关重要的作用,它们是探测细胞成骨分化水平高低的关键靶点。本研究通过上述一系列成骨分化相关的检测实验,发现Fischer-Koch S 支架、Diamond 支架和Double Gyroid 支架能诱导成骨细胞分泌产生更多的胞外钙结节沉积,同时能够显著提升成骨细胞胞内ALP活性水平。在成骨分化基因的表达水平方面,结果表明Runx-2 基因在Fischer-Koch S 组、Diamond 组和Double Gyroid 组细胞中表达水平较高;OCN 基因和OPN 基因在Fischer-Koch S 组细胞中表达水平较高;ALP 基因同样在Fischer-Koch S 组、Diamond 组和Double Gyroid组细胞中表达水平较高。除了上述的体外细胞实验,本研究还额外开展了家兔的体内动物实验,体内micro-CT 分析和组织切片分析结果表明,Fischer-Koch S、Diamond 和Double Gyroid 支架具有更强的体内骨再生诱导能力。综合分析本研究所开展的体内外生物实验,可以发现Fischer-Koch S、Diamond 和Double Gyroid 多孔结构对提升细胞或组织的成骨再生能力效果突出,其中又以Fischer-Koch S 支架的功效最为突出,Fischer-Koch S 支架几乎在各个实验结果中都表现出了优良的促成骨能力。因此研究证明,Fischer-Koch S 结构在这四种拓扑结构中最适合用于提升多孔钛支架的骨再生能力。在这四种结构中,该结构在促进骨再生方面的生物学效应最为广泛,并且促成骨功能在这四种拓扑结构中表现得最为稳定。除此之外,我们还继续探究了成纤维细胞(C3H10T1/2)在四种多孔钛合金支架中的增殖活性和肌腱/韧带分化能力的差异,希望能够比较得到这四种多孔钛支架在促进肌腱/韧带再生方面的性能差异。FITC-phalloidin/DAPI 染色实验结果显示,丰富的细胞骨架和延伸的细胞形态仅于Fischer-Koch S 组、Octet 组和Double Gyroid 组中观察到,这相较于这三种结构,Diamond 型支架中生长的成纤维细胞迁移和浸润能力较差。活/死细胞染色和CCK-8 染色实验结果显示,成纤维细胞在Fischer-Koch S 组、Octet 组和Double Gyroid 组中增殖生长地较快。这些实验可以表明,我们能够初步筛选出Fischer-Koch S、Octet 和Double Gyroid 结构,用来进一步提升多孔支架中成纤维细胞的生长与增殖活性。此外,我们开展了相应的RT-PCR 实验,检测了四种多孔支架中成纤维细胞的肌腱/韧带分化相关基因(Col1a1、DCN、SCX)的表达水平。Col1a1 基因的功能是编码合成胶原前体α1(I)肽链,它是进一步合成I 型胶原大分子的重要前体物质[62]。I 型胶原是肌腱/韧带组织中最主要的细胞外基质成分。因此,Col1a1 基因的表达水平可以用来反映受损肌腱/韧带组织内的再生程度[63-65]。DCN 是富含亮氨酸的小分子蛋白聚糖(Small Leucine-rich Proteoglycan, SLRP)其中的一个代表分子,它在胶原纤维的组装和交联中起到至关重要的作用[66]。DCN 表达越高,再生的肌腱/韧带组织就会越加坚韧[67, 68]。此外,SCX 是碱性螺旋-环-螺旋(Basic Helix-loop-helix, bHLH)家族中的一个重要的转录因子,一般存在于肌腱/韧带组织中,对肌腱/韧带组织的延伸和成熟具有调节的作用[69-71]。因此,Col1a1、DCN、SCX 这三个基因是检测肌腱/韧带分化水平的关键靶点。本研究通过实验最终发现,Col1a1 基因和DCN 基因在Octet 支架组的成纤维细胞内表达水平较高,且SCX 基因在Octet 和Double Gyroid 支架组的成纤维细胞内表达水平较高。因此,Octet 结构被认为在提升支架的促肌腱/韧带再生能力方面是这四种多孔支架中效果最为突出的,该结构在提升肌腱/韧带组织的再生与分化上效果最为广泛与稳定。由此我们可以得出,钛合金支架中Fischer-Koch S、Octet、Diamond和Double Gyroid 四种不同的多孔拓扑结构对骨和肌腱/韧带的再生能产生一定的影响,四种不同支架的成骨与成肌腱/韧带性能具有一定的差异。Fischer-Koch S 结构对促进骨组织再生的效果较好,而Octet结构对肌腱/韧带组织再生的效果最好。因此,我们认为应用于肌腱/韧带重建这一临床情景中的钛合金螺钉最好设计成Fischer-Koch SOctet双层复合结构。螺钉的主体部分主要和骨组织相互接触,因此主体部分应该设计成Fischer-Koch S 结构;螺钉和原位嵌入固定的断裂肌腱/韧带末端相互接触的部分则应该设计成Octet 结构,这部分结构占螺钉总体的长度比例大致应由固定的断裂肌腱/韧带末端在骨隧道内的长度而确定。钛合金螺钉除了应用于上述肌腱/韧带重建的情景外,在临床中还广泛应用于其他类型的骨科手术中,如骨折的螺钉内固定、钉棒固定系统的植入、牙修复体的植入等[72-74]。在这些临床情景中,传统的实心钛合金螺钉同样会造成应力屏蔽现象与术后螺钉的松动问题,因此也应该采用多孔的整体设计替代传统的简单实心设计,在这些临床情景中,我们同样可以在螺钉并引入Fischer-Koch S 的多孔结构,从而提高螺钉的成骨性能,诱导更多的新生骨组织再生并与产生更紧密的整合,进一步提高其长期的固定效果。除了上述螺钉,Fischer-Koch S 结构还可以应用于其他类型的骨科植入物中,包括下颌骨重建中的缺损植入物、人工骨板植入物以及椎间盘切除术中使用到的椎间融合器等[75]。这些螺钉和植入物可以使用钛合金材料和EBM 3D 技术制造,也可以采取其他的金属材料(如镁、锌等),高分子聚合物材料(如聚乙醇酸、聚醚醚酮等),或者采用其他类型的打印制造技术(如选择性激光烧结技术、立体光刻设备技术等)来进行打印与制造。只有最终在这些植入物中引入了Fischer-Koch S 的超材料多孔结构,植入物的综合成骨能力将会得到显著地提升。与 Octet 结构相比,Fischer-Koch S、Diamond 和Double Gyroid结构在促进骨组织再生方面效果整体上更为显著,这三种结构均属于TPMS 结构范畴。TPMS 结构的典型特征是表面平均曲率为零,不存在表面自交[37, 76],这种特殊的结构特征可能是造成其自身具有优良骨组织再生能力的潜在原因。Octet 是一种经典的原型拓扑结构,它的内部主体是由一个个的三角形结构组成,内部相邻的梁柱彼此是以45°的角度而相互交错[39, 40]。这种结构在促进骨组织再生方面可能优势不明显,但在促进肌腱/韧带组织再生和分化方面优势比较突出。因此我们可以将Fischer-Koch S 和Octet 结构综合应用于肌腱/韧带重建的钛合金螺钉中,将螺钉大致设计成一个双层的复合结构,植入后与骨组织相接触的部分设计成Fischer-Koch S 结构,而与肌腱/韧带组织接触的部分设计成Octet 结构。这种Fischer-Koch S-Octet 双层多孔螺钉最终将发挥类似于自体腱端组织(天然肌腱/韧带中的关键组织区域)的桥接功能,从而将硬组织(骨)和软组织(肌腱/韧带)成功地连接起来。自体腱端组织是肌腱/韧带组织中的多层结缔组织区,具有典型的肌腱/韧带-软骨-骨的三层过渡结构[65]。因此,对于螺钉优化的双层多孔设计,我们未来还可以基于该设计做进一步的优化,可以在Fischer-Koch S-Octet 这两层之间添加一个额外的多孔层,来促进软骨组织再生,从而模拟出天然腱端组织的肌腱/韧带固定效果。因此,Fischer-Koch S、Diamond 和Double Gyroid 这四种多孔结构的成软骨性能有待进一步开展相关实验进行比较,从而筛选出促软骨再生优势最显著的一种,并应用于肌腱/韧带重建的钛合金螺钉中,相信能够在双层设计基础上进一步提升螺钉对肌腱/韧带的重建与固定效果。除了本文涉及到的四种多孔结构,增材制造拓扑优化的研究领域内还存在着许多其他种类的多孔结构,如Schwarz P 结构[77, 78],F-RD 结构[79, 80]与I-WP结构等[81, 82],这些结构同样具有优秀的机械性能,但其在促进人体组织再生方面的功能仍有待进一步的发掘与研究,因此,这些相关结构下的多孔植入物在骨科临床中的应用也将成为日后研究的一大热点。 
多孔结构设计的螺钉更有利于肌腱/韧带的重建,能够显著提高螺钉植入后的长期固定效果。多孔结构的引入,使得螺钉弹性模量降低到小梁骨组织的合理值范围内,从而有效避免应力屏蔽问题。研究初步验证了四种经典的增材制造多孔设计(Fisher - koch S, Octet,Diamond, Double Gyroid),在这四种结构中,Fischer-Koch S 结构更有利于骨再生,Octet 结构更适合改善肌腱/韧带再生,因此提出Fisher- koch S-Octet 两层结构的构想,可用于肌腱/韧带重建螺钉的拓扑优化,以提高其植入术后长期的固定效果。 [1] A. Gautieri, S. Vesentini, A. Redaelli, M.J. Buehler, Hierarchical Structure and Nanomechanics of Collagen Microfibrils from the Atomistic Scale Up, Nano Lett. 11(2) (2011) 757-766.[2] P. Kannus, Structure of the tendon connective tissue, Scand. J. Med. Sci. Sports 10(6) (2000) 312-320.[3] J. Kastelic, A. Galeski, E. Baer, The multicomposite structure of tendon, Connective tissue research 6(1) (1978) 11-23.[4] S.P. Reese, S.A. Maas, J.A. Weiss, Micromechanical models of helical superstructures in ligament and tendon fibers predict large Poisson's ratios, Journal of Biomechanics 43(7) (2010) 1394-1400.[5] J. Fallon, F.T. Blevins, K. Vogel, J. Trotter, Functional morphology of the supraspinatus tendon, J. Orthop. Res. 20(5) (2002) 920-926.[6] G.P. Hess, W.L. Cappiello, R.M. Poole, S.C. Hunter, Prevention and treatment of overuse tendon injuries, Sports medicine (Auckland, N.Z.) 8(6) (1989) 371-84.[7] H. Karimi, K. Seyed-Forootan, A.-M. Karimi, Stem Cells and Tendon Regeneration, in: D. Duscher, M.A. Shiffman (Eds.), Regenerative Medicine and Plastic Surgery: Skin and Soft Tissue, Bone, Cartilage, Muscle, Tendon and Nerves, Springer International Publishing, Cham, 2019, pp. 369-384.[8] F. Tencone, S. Della Villa, A. Giannini, Conservative Treatments for Tendinopathy, in: G.L. Canata, P. d'Hooghe, K.J. Hunt (Eds.), Muscle and Tendon Injuries: Evaluation and Management, Springer Berlin Heidelberg, Berlin, Heidelberg, 2017, pp. 157-174.[9] J.B. Tang, Tendon injuries across the world: Treatment, Injury-Int. J. Care Inj. 37(11) (2006) 1036-1042.[10] D.E. Birk, E. Zycband, Assembly of the tendon extracellular matrix during development, Journal of anatomy 184 ( Pt 3) (1994) 457-63.[11] R. Strocchi, V. De Pasquale, S. Guizzardi, P. Govoni, A. Facchini, M. Raspanti, M. Girolami, S. Giannini, Human Achilles tendon:morphological and morphometric variations as a function of age, Foot & ankle 12(2) (1991) 100-4.[12] M. Oberst, G. Konrad, G.W. Herget, A. El Tayeh, N.P. Suedkamp, Novel endoscopic sacroiliac screw removal technique: reduction of intraoperative radiation exposure, Archives of Orthopaedic and Trauma Surgery 134(11) (2014) 1557-1560.[13] D. Schönegg, A. Koch, G.T. Müller, M. Blumer, M.E.H. Wagner, Twoscrew osteosynthesis of the mandibular condylar head with different screw materials: a finite element analysis, Computer Methods in Biomechanics and Biomedical Engineering (2023).[14] J.H. Oh, Y.S. Kim, J.Y. Lim, B.H. Choi, Stress Distribution on the Prosthetic Screws in the All-on-4 Concept: A Three-Dimensional Finite Element Analysis, Journal of Oral Implantology 46(1) (2020) 3-12.[15] Y. Hirai, K. Watanabe, T. Deguchi, K. Ueda, K. Hamada, E. Tanaka, Influence of insertion depth on stress distribution in orthodontic miniscrew and the surrounding bone by finite element analysis, Dental Materials Journal 40(5) (2021) 1270-1276.[16] K. Haase, G. Rouhi, Prediction of stress shielding around an orthopedic screw: Using stress and strain energy density as mechanical stimuli, Computers in Biology and Medicine 43(11) (2013) 1748-1757.[17] S. Kuroda, Y. Nishii, S. Okano, K. Sueishi, Stress distribution in the mini-screw and alveolar bone during orthodontic treatment: a finite element study analysis, Journal of orthodontics 41(4) (2014) 275-84.[18] M. Torabi, S. Khorramymehr, M. Nikkhoo, M. Rostami, The role of orthopedic screws threads properties on the success of femoral fracture fixation, Proceedings of the Institution of Mechanical Engineers Part CJournal of Mechanical Engineering Science 236(17) (2022) 9419-9430.[19] M. Be'ery-Lipperman, A. Gefen, A method of quantification of stress shielding in the proximal femur using hierarchical computational modeling, Computer methods in biomechanics and biomedical engineering 9(1) (2006) 35-44.[20] S.H. Naidu, Interference Screw Failure in Distal Biceps Endobutton Repair: Case Report, Journal of Hand Surgery-American Volume 35A(9)(2010) 1510-1512.[21] A. Persson, T. Gifstad, M. Lind, L. Engebretsen, K. Fjeldsgaard, J.O. Drogset, M. Forssblad, B. Espehaug, A.B. Kjellsen, J.M. Fevang, Graft fixation influences revision risk after ACL reconstruction with hamstring tendon autografts: A study of 38,666 patients from the Scandinavian knee ligament registries 2004-2011, Acta Orthopaedica 89(2) (2018) 204-210.[22] K. Shyam, P.B. Thippeswamy, S.R. Sundararajan, S. Rajasekaran, Peek screw displacement after PCL reconstruction: A radiographic red herring solved by MRI, Journal of Radiology Case Reports 16(5) (2022)10-16.[23] D. Wu, P. Isaksson, S.J. Ferguson, C. Persson, Young's modulus of trabecular bone at the tissue level: A review, Acta Biomaterialia 78 (2018)1-12.[24] A.C. Jones, C.H. Arns, A.P. Sheppard, D.W. Hutmacher, B.K. Milthorpe, M.A. Knackstedt, Assessment of bone ingrowth into porous biomaterials using MICRO-CT, Biomaterials 28(15) (2007) 2491-2504.[25] C. Wu, J.G. Fang, A. Entezari, G.Y. Sun, M.V. Swain, Y.N. Xu, G.P. Steven, Q. Li, A time-dependent mechanobiology-based topology optimization to enhance bone growth in tissue scaffolds, Journal of Biomechanics 117 (2021).[26] H. Tiainen, J.C. Wohlfahrt, A. Verket, S.P. Lyngstadaas, H.J. Haugen, Bone formation in TiO<sub>2</sub> bone scaffolds in extraction sockets of minipigs, Acta Biomaterialia 8(6) (2012) 2384-2391.[27] J. Li, X.L. Cui, G.J. Hooper, K.S. Lim, T.B.F. Woodfield, Rational design, bio-functionalization and biological performance of hybrid additive manufactured titanium implants for orthopaedic applications: A review, J. Mech. Behav. Biomed. Mater. 105 (2020) 18.[28] H.J. Cao, L.F. Feng, Z.X. Wu, W.T. Hou, S.J. Li, Y.L. Hao, L. Wu, Effect of low-intensity pulsed ultrasound on the biological behavior of osteoblasts on porous titanium alloy scaffolds: An in vitro and in vivo study, Mater. Sci. Eng. C-Mater. Biol. Appl. 80 (2017) 7-17.[29] Y.S. Cho, J.S. Lee, M.W. Hong, S.H. Lee, Y.Y. Kim, Y.S. Cho, Comparative Assessment of the Ability of Dual-Pore Structure and Hydroxyapatite to Enhance the Proliferation of Osteoblast-Like Cells in Well-Interconnected Scaffolds, Int. J. Precis. Eng. Manuf. 19(4) (2018) 605-612.[30] Q. Zhang, H.X. Lu, N. Kawazoe, G.P. Chen, Preparation of collagen scaffolds with controlled pore structures and improved mechanical property for cartilage tissue engineering, J. Bioact. Compat. Polym. 28(5)(2013) 426-438.[31] X.M. Shi, A. Nommeots-Nomm, N.M. Todd, A. Devlin-Mullin, H. Geng, P.D. Lee, C.A. Mitchell, J.R. Jones, Bioactive glass scaffold architectures regulate patterning of bone regeneration <i>in vivo</i>, Appl. Mater. Today 20 (2020) 11.[32] H. Zhu, M. Li, X.L. Huang, D.H. Qi, L.P. Nogueira, X. Yuan, W.B. Liu, Z.H. Lei, J.W. Jiang, H.L. Dai, J. Xiao, 3D printed tricalcium phosphate-bioglass scaffold with gyroid structure enhance bone ingrowth in challenging bone defect treatment, Appl. Mater. Today 25 (2021) 15.[33] C.N. Sun, E.C. Dong, J.Y. Chen, J.B. Zheng, J.F. Kang, Z.M. Jin, C.Z. Liu, L. Wang, D.C. Li, The Promotion of Mechanical Properties by Bone Ingrowth in Additive-Manufactured Titanium Scaffolds, J. Func. Biomater.13(3) (2022) 16.[34] D.J. Yoo, Porous scaffold design using the distance field and triply periodic minimal surface models, Biomaterials 32(31) (2011) 7741-7754.[35] A. Karakoç, RegionTPMS - Region based triply periodic minimal surfaces (TPMS) for 3-D printed multiphase bone scaffolds with exact porosity values, SoftwareX 16 (2021) 8.[36] H. Chen, Q. Han, C.Y. Wang, Y. Liu, B.P. Chen, J.C. Wang, Porous Scaffold Design for Additive Manufacturing in Orthopedics: A Review,Front. Bioeng. Biotechnol. 8 (2020) 20.[37] Y.T. Lu, W.Y. Zhao, Z.T. Cui, H.X. Zhu, C.W. Wu, The anisotropic elastic behavior of the widely-used triply-periodic minimal surface based scaffolds, J. Mech. Behav. Biomed. Mater. 99 (2019) 56-65.[38] Y.T. Lu, Y. Huo, J.A. Zou, Y.C. Li, Z.Y. Yang, H.X. Zhu, C.W. Wu,Comparison of the design maps of TPMS based bone scaffolds using a computational modeling framework simultaneously considering various conditions, Proc. Inst. Mech. Eng. Part H-J. Eng. Med. 236(8) (2022) 1157- 1168.[39] L.P. Wang, Q. Chen, P. Yarlagadda, F.P. Zhu, Q.W. Li, Z.Y. Li, Singleparameter mechanical design of a 3D-printed octet truss topological scaffold to match natural cancellous bones, Mater. Des. 209 (2021) 12.[40] S. Arabnejad, R.B. Johnston, J.A. Pura, B. Singh, M. Tanzer, D. Pasini, High-strength porous biomaterials for bone replacement: A strategy to assess the interplay between cell morphology, mechanical properties, bone ingrowth and manufacturing constraints, Acta Biomaterialia 30 (2016) 345-356.[41] M. Nonomura, K. Yamada, T. Ohta, Formation and stability of double gyroid in microphase-separated diblock copolymers, J. Phys.-Condes.Matter 15(26) (2003) L423-L430.[42] A. Aksimentiev, M. Fialkowski, R. Holyst, Morphology of surfaces in mesoscopic polymers, surfactants, electrons, or reaction-diffusion systems: Methods, simulations, and measurements, in: I. Prigogine, S.A. Rice (Eds.), Advances in Chemical Physics, Volume 121, John Wiley & Sons Inc,Hoboken, 2002, pp. 141-239.[43] F. Sadeghi, M. Baniassadi, A. Shahidi, M. Baghani, TPMS metamaterial structures based on shape memory polymers: Mechanical,thermal and thermomechanical assessment, J. Mater. Res. Technol-JMRT 23 (2023) 3726-3743.[44] N.V. Viet, N. Karathanasopoulos, W. Zaki, Mechanical attributes and wave propagation characteristics of TPMS lattice structures, Mech. Mater. 172 (2022) 12.[45] B.M. Cote, W.R. Lenart, C.J. Ellison, V.E. Ferry, Surface Structure Dependent Circular Dichroism in Single and Double Gyroid Metamaterials,Adv. Opt. Mater. 10(13) (2022) 10.[46] Y.T. Lu, L.L. Cheng, Z.Y. Yang, J.Y. Li, H.X. Zhu, Relationship between the morphological, mechanical and permeability properties of porous bone scaffolds and the underlying microstructure, PLoS One 15(9) (2020) 19.[47] J. Li, D.S. Chen, H.Q. Luan, Y.Y. Zhang, Y.B. Fan, Numerical Evaluation and Prediction of Porous Implant Design and Flow Performance, Biomed Res. Int. 2018 (2018) 13.[48] I. Maskery, N.T. Aboulkhair, A.O. Aremu, C.J. Tuck, I.A. Ashcroft, Compressive failure modes and energy absorption in additively manufactured double gyroid lattices, Addit. Manuf. 16 (2017) 24-29.[49] M. McGregor, S. Patel, S. McLachlin, M. Vlasea, Architectural bone parameters and the relationship to titanium lattice design for powder bed fusion additive manufacturing, Addit. Manuf. 47 (2021) 18.[50] C.M. Haslauer, J.C. Springer, O.L.A. Harrysson, E.G. Loboa, N.A. Monteiro-Riviere, D.J. Marcellin-Little, <i>In vitro</i> biocompatibility of titanium alloy discs made using direct metal fabrication, Med. Eng. Phys. 32(6) (2010) 645-652.[51] F. Bartolomeu, M.M. Costa, N. Alves, G. Miranda, F.S. Silva,Selective Laser Melting of Ti6Al4V sub-millimetric cellular structures:Prediction of dimensional deviations and mechanical performance, J. Mech. Behav. Biomed. Mater. 113 (2021) 9.[52] J.P. Li, J.R. de Wijn, C.A. van Blitterswijk, K. de Groot, The effect of scaffold architecture on properties of direct 3D fiber deposition of porous Ti6Al4V for orthopedic implants, J. Biomed. Mater. Res. Part A 92A(1)(2010) 33-42.[53] J.J. Weng, Y. Su, Nuclear matrix-targeting of the osteogenic factor Runx2 is essential for its recognition and activation of the alkaline phosphatase gene, Biochim. Biophys. Acta-Gen. Subj. 1830(3) (2013)2839-2852.[54] P. Ducy, R. Zhang, V. Geoffroy, A.L. Ridall, G. Karsenty, Osf2/Cbfa1: a transcriptional activator of osteoblast differentiation, Cell 89(5) (1997) 747-54.[55] U. Kresnoadi, M. Nizar, Soekobagiono, Increased Expression of RUNX2 and ALP Resulting from a Combination of Propolis Extract and Bovine Bone Graft in Socket Preservation Material, Braz. J. Pharm. Sci.58 (2022) 12.[56] S. Thanakun, C.P.N. Mahasarakham, S. Pomprasertsuk-Damrongsri, Y. Izumi, Correlation of plasma osteopontin and osteocalcin with lower renal function in dental patients with carotid artery calcification and tooth loss, J. Oral Biosci. 61(3) (2019) 183-189.[57] J.Y. Si, C.W. Wang, D.H. Zhang, B. Wang, W.W. Hou, Y. Zhou, Osteopontin in Bone Metabolism and Bone Diseases, Med. Sci. Monitor 26 (2020) 9.[58] A. Singh, G. Gill, H. Kaur, M. Amhmed, H. Jakhu, Role of osteopontin in bone remodeling and orthodontic tooth movement: a review, Prog. Orthod. 19 (2018) 8.[59] M. Ikegame, S. Ejiri, H. Okamura, Expression of Non-collagenous Bone Matrix Proteins in Osteoblasts Stimulated by Mechanical Stretching in the Cranial Suture of Neonatal Mice, J. Histochem. Cytochem. 67(2) (2019) 107-116.[60] T. Komori, Functions of Osteocalcin in Bone, Pancreas, Testis, and Muscle, Int. J. Mol. Sci. 21(20) (2020) 15.[61] E. Duman, E.S. Kehribar, R.E. Ahan, E. Yuca, U. Seker, Biomineralization of Calcium Phosphate Crystals Controlled by Protein- Protein Interactions, ACS Biomater. Sci. Eng. 5(9) (2019) 4750-4763.[62] Y.Q. Lu, S. Zhang, Y.Z. Wang, X.Z. Ren, J.X. Han, Molecular mechanisms and clinical manifestations of rare genetic disorders associated with type I collagen, Intractable Rare Dis. Res. 8(2) (2019) 98-107.[63] F.G. Thankam, M.F. Dilisio, R.M. Gross, D.K. Agrawal, Collagen I: a kingpin for rotator cuff tendon pathology, Am. J. Transl. Res. 10(11) (2018) 3291-3309.[64] C. Wan, Z.X. Hao, S.Z. Wen, H.J. Leng, A Quantitative Study of the Relationship between the Distribution of Different Types of Collagen and the Mechanical Behavior of Rabbit Medial Collateral Ligaments, PLoS One 9(7) (2014) 9.[65] W.W. Luo, Y. Wang, Q. Han, Z.H. Wang, J.H. Jiao, X.Q. Gong, Y. Liu,A.B. Zhang, H. Zhang, H. Chen, J.C. Wang, M.F. Wu, Advanced strategies for constructing interfacial tissues of bone and tendon/ligament, J. Tissue Eng. 13 (2022) 31.[66] E.V. Geiger, D. Henrich, S. Wutzler, D.S. Ller, H. Jakob, J.M. Frank,I. Marzi, The Role of <i>TNXB</i> Single-Nucleotide Polymorphisms in Recurrent Shoulder Dislocation, J. Orthop. Res. 31(2) (2013) 295-299.[67] G.Y. Zhang, Y. Ezura, I. Chervoneva, P.S. Robinson, D.P. Beason, E.T. Carine, L.J. Soslowsky, R.V. Iozzo, D.E. Birk, Decorin regulates assembly of collagen fibrils and acquisition of biomechanical properties during tendon development, J. Cell. Biochem. 98(6) (2006) 1436-1449.[68] S. Matheson, H. Larjava, L. Häkkinen, Distinctive localization and function for lumican, fibromodulin and decorin to regulate collagen fibril organization in periodontal tissues, J. Periodont. Res. 40(4) (2005) 312-324.[69] P. Alberton, C. Popov, M. Prägert, J. Kohler, C. Shukunami, M. Schieker, D. Docheva, Conversion of Human Bone Marrow-Derived Mesenchymal Stem Cells into Tendon Progenitor Cells by Ectopic Expression of Scleraxis, Stem Cells and Development 21(6) (2012) 846-858.[70] A.H. Huang, S.S. Watson, L.Y. Wang, B.M. Baker, H. Akiyama, J.V.Brigande, R. Schweitzer, Requirement for scleraxis in the recruitment of mesenchymal progenitors during embryonic tendon elongation, Development 146(20) (2019) 8.[71] C. Shukunami, A. Takimoto, Y. Nishizaki, Y. Yoshimoto, S. Tanaka, S.Miura, H. Watanabe, T. Sakuma, T. Yamamoto, G. Kondoh, Y. Hiraki, Scleraxis is a transcriptional activator that regulates the expression of Tenomodulin, a marker of mature tenocytes and ligamentocytes, Sci Rep 8 (2018) 17.[72] J.J. Luo, M. Tamaddon, C.Y. Yan, S.H. Ma, X.L. Wang, F. Zhou, C.Z.Liu, Improving the fretting biocorrosion of Ti<sub>6</sub>Al<sub>4</sub>V alloy bone screw by decorating structure optimised TiO<sub>2</sub> nanotubes layer, J. Mater. Sci. Technol. 49 (2020) 47-55.[73] H. Liang, T. Ji, Y. Zhang, Y. Wang, W. Guo, Reconstruction with 3Dprinted pelvic endoprostheses after resection of a pelvic tumour, Bone Joint J. 99B(2) (2017) 267-275.[74] R. Jayasree, K. Raghava, M. Sadhasivam, P.V.V. Srinivas, R. Vijay, K.G. Pradeep, T. Rao, D. Chakravarty, Bi-layered metal-ceramic component for dental implants by spark plasma sintering, Mater. Lett. 344 (2023) 4.[75] J.H. Tan, C.K. Cheong, H.W.D. Hey, Titanium (Ti) cages may be superior to polyetheretherketone (PEEK) cages in lumbar interbody fusion: a systematic review and meta-analysis of clinical and radiological outcomes of spinal interbody fusions using Ti versus PEEK cages,European Spine Journal 30(5) (2021) 1285-1295.[76] A. Ronca, L. Ambrosio, D.W. Grijpma, Design of porous threedimensional PDLLA/nano-hap composite scaffolds using stereolithography, J. Appl. Biomater. Funct. Mater. 10(3) (2012) 249-258.[77] J.X. Cai, Y.B. Ma, Z.C. Deng, On the effective elastic modulus of the ribbed structure based on Schwarz Primitive triply periodic minimalsurface, Thin-Walled Struct. 170 (2022) 10.[78] W. Liu, L. Sang, Z.H. Zhang, S.L. Ju, F. Wang, Y.P. Zhao, Compression and resilient behavior of graded triply periodic minimal surface structures with soft materials fabricated by fused filament fabrication, J. Manuf. Process. 105 (2023) 1-13.[79] N. Qiu, Y.H. Wan, Y.J. Shen, J.G. Fang, Experimental and numerical studies on mechanical properties of TPMS structures, Int. J. Mech. Sci. 261 (2024) 18.[80] T.Y. Gao, K. Liu, X.X. Wang, Z.D. Li, Z.G. Wang, Elastic mechanical property hybridization of configuration-varying TPMS with geometri continuity, Mater. Des. 221 (2022) 15.[81] X.X. Wang, T.Y. Gao, C. Shi, Y. Zhou, Z.D. Li, Z.G. Wang, Effect of geometric configuration on compression behavior of 3D-printed polymeric triply periodic minimal surface sheets, Mech. Adv. Mater. Struct. 30(11)(2023) 2304-2314.[82] E.N. Ahmed, A. Bottaro, Flow through porous metamaterials formed by TPMS-based unit cells: Effects of advection, Eur. J. Mech. B-Fluids 100(2023) 202-207.

















 扫一扫 关注我们
扫一扫 关注我们